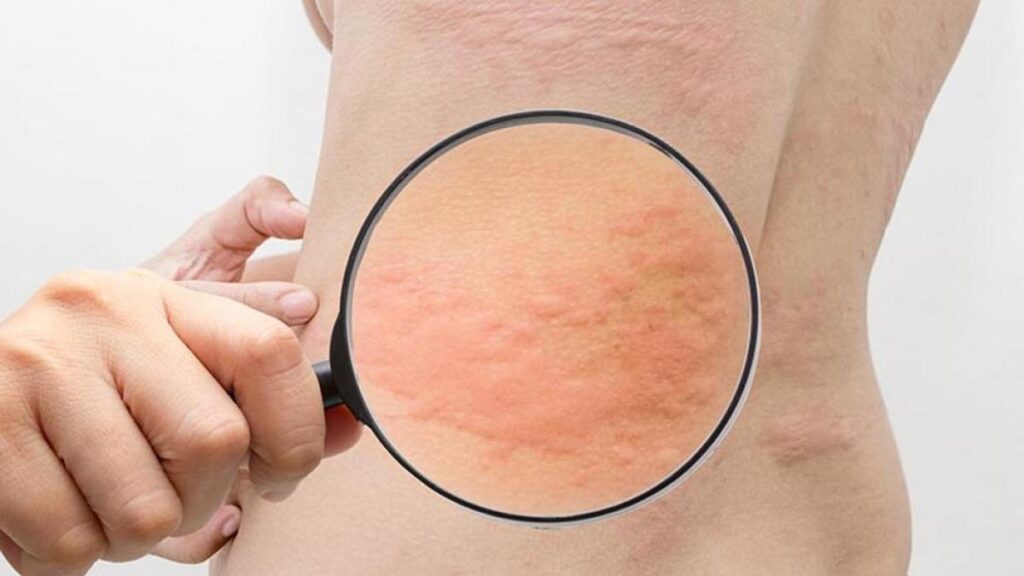
El ensayo RILECSU confirmó que rilzabrutinib mejora los síntomas de la urticaria crónica espontánea refractaria a antihistamínicos
Lugones Editorial©
La urticaria crónica espontánea es una enfermedad inflamatoria común de la piel caracterizada por la aparición espontánea de picazón, angioedema o ambos. En este artículo, los autores indagan cuál es la eficacia y el perfil de riesgo de rilzabrutinib en adultos con urticaria crónica espontánea refractaria a los antihistamínicos.
- El tratamiento de primera línea incluye a los antihistamínicos H1 de segunda generación. Sin embargo, aproximadamente la mitad de los pacientes adultos es refractaria a los antihistamínicos H1 a la dosis estándar.
- El tratamiento de segunda línea incluye una escalada de hasta cuatro veces la dosis estándar de antihistamínicos H1; sin embargo, la tasa de éxito para los pacientes se mantiene en aproximadamente del 45% al 55%, y la escalada de la dosis se asocia con un aumento de la somnolencia.
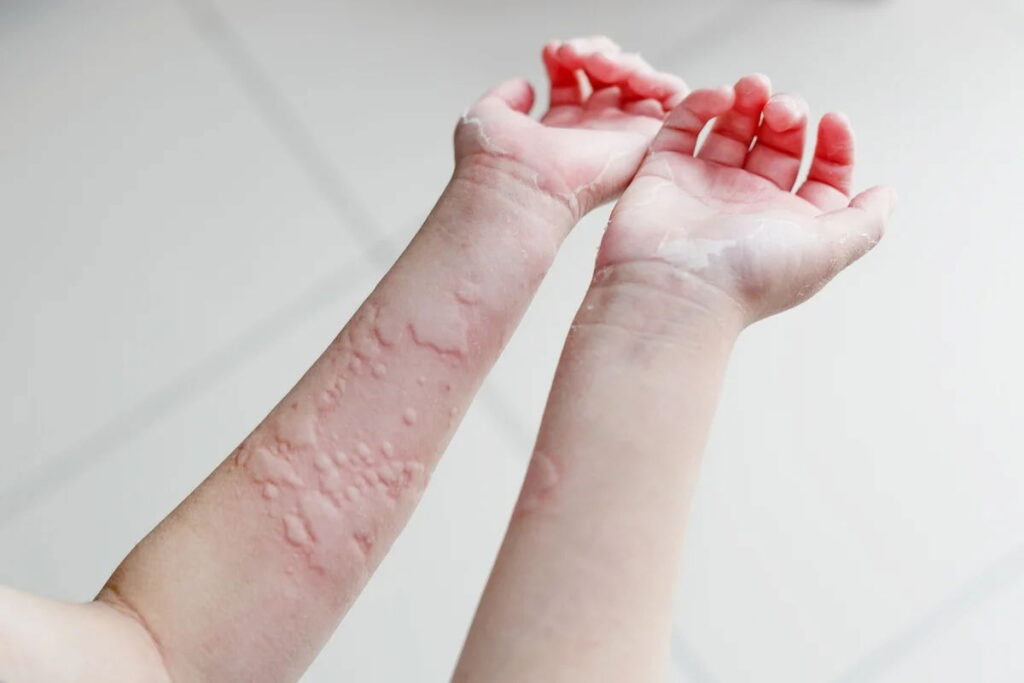
Los autores se cuestionan cuál es la eficacia y el perfil de riesgo de rilzabrutinib en adultos con urticaria crónica espontánea refractaria a los antihistamínicos
Acerca del BTK
La urticaria crónica espontánea (UCE) es impulsada principalmente por la activación de los mastocitos cutáneos a través de varios mecanismos. Bruton tirosina quinasa (BTK), expresada en células B y mastocitos, desempeña un papel fundamental en múltiples procesos de enfermedad inmunomediados.
La BTK se considera un objetivo terapéutico potencial para el tratamiento de la UCE, ya que está involucrada en la señalización mediada por IgE y mediada por IgG en mastocitos y basófilos, y probablemente juega un papel en el desarrollo de células B autorreactivas y la producción de autoanticuerpos.
Sin embargo, se han asociado con efectos adversos raros, pero graves, fuera del objetivo, incluyendo sangrado, citopenia, arritmias cardíacas e infección. Se están desarrollando BTKI con mayor selectividad y menos efectos adversos para el tratamiento de enfermedades autoinmunes, incluida la UCE.
El rilzabrutinib es un BTKI oral, reversible y covalente de próxima generación con alta especificidad objetivo que actúa sobre múltiples vías tanto en células innatas como adaptativas.
En este ensayo clínico aleatorizado de Eficacia de Rilzabrutinib en UCE (RILECSU), la eficacia y los efectos adversos asociados con rilzabrutinib se evaluaron durante el período de doble ciego de 12 semanas en pacientes con UCE cuya enfermedad no se controló adecuadamente con antihistamínicos H1.
Resumen
Diseño
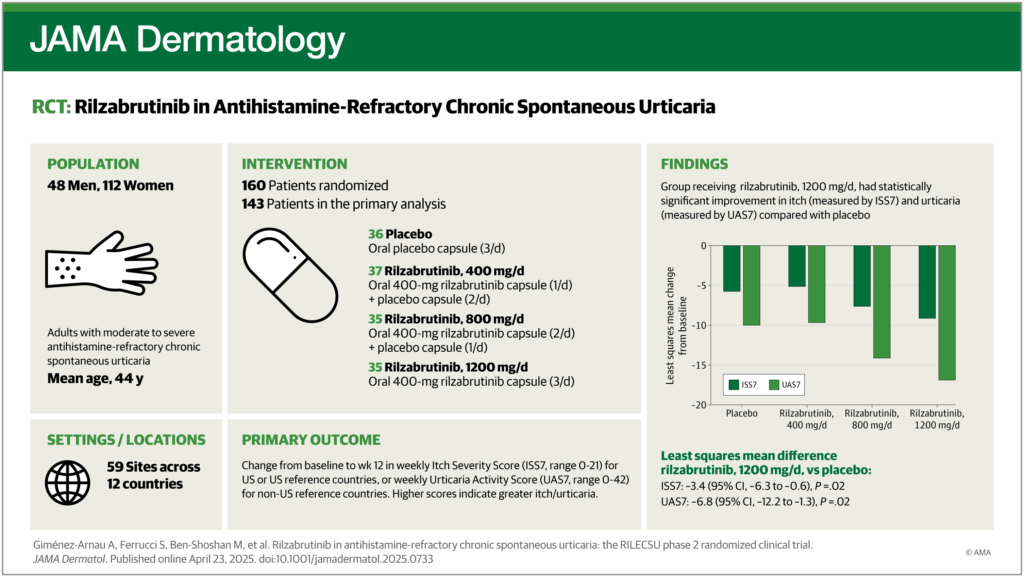
El ensayo clínico aleatorizado de eficacia y seguridad de rilzabrutinib en la UCE (RILECSU) fue un estudio de fase 2 de 52 semanas que comprendía un período de dosis de 12 semanas, doble ciego, controlado con placebo, seguido de una extensión abierta de 40 semanas.
Cincuenta y un centros inscribieron y aleatorizaron a participantes en 12 países de Asia, Europa, América del Norte y América del Sur. Los participantes del ensayo incluyeron adultos de 18 a 80 años con UCE moderada a grave (puntuación semanal de actividad de urticaria [UAS7] de 16 o más; puntuación semanal de gravedad de la picazón [ISS7] de 8 o más) no controlada adecuadamente con el tratamiento antihistamínico con H1.
Los pacientes fueron asignados al azar 1:1:1:1 a rilzabrutinib, 400 mg, una vez cada noche (400 mg/d), dos veces al día (800 mg/d), 3 veces al día (1200 mg/d) o placebo correspondiente.
Rilzabrutinib, 1200 mg/d, disminuyó significativamente la puntuación semanal de la actividad urticaria de los pacientes y sus componentes
Resultados
- Se aleatorizó a un total de 160 pacientes sin tratamiento previo con omalizumab y con respuesta incompleta al mismo (edad media [DE]: 44,1 [13,4] años; 112 [70,0%] mujeres).
- La población de análisis principal incluyó únicamente a los 143 pacientes sin tratamiento previo con omalizumab.
- Se observaron reducciones significativas en la semana 12 con rilzabrutinib, 1200 mg/día, frente a placebo desde el inicio en ISS7 (media de mínimos cuadrados [MC], -9,21 frente a -5,77; diferencia, -3,44 [IC del 95 %, -6,25 a -0,62]; P = 0,02) y UAS7 (media de MC, -16,89 frente a -10,14; diferencia, -6,75 [IC del 95 %, -12,23 a -1,26]; P = 0,02).
- Además, se observaron mejoras en la puntuación semanal de gravedad de la urticaria (HSS7) y la puntuación semanal de actividad del angioedema (AAS7).
- Se encontraron mejoras en ISS7, UAS7, HSS7 y AAS7 ya en la semana 1.
- Los biomarcadores relacionados con la UCE, incluido el receptor X2 acoplado a proteína G soluble relacionada con Mas, la inmunoglobulina (Ig)-G antiperoxidasa tiroidea, el receptor 1 anti-Fc-ε de IgG y la interleucina-31, se redujeron en comparación con placebo en la semana 12.
Rilzabrutinib demostró un perfil de riesgo-beneficio favorable; los eventos adversos que ocurrieron con mayor frecuencia con rilzabrutinib frente a placebo incluyeron diarrea, náuseas y dolor de cabeza.
Debate
El ensayo RILECSU es el primer estudio aleatorizado de fase 2 que evalúa la eficacia y el perfil riesgo-beneficio de rilzabrutinib en pacientes con urticaria crónica espontánea (UCE) no controlada con antihistamínicos H1.
Los resultados muestran que la dosis de 1200 mg/día cumplió el criterio de valoración primario y la mayoría de los secundarios, con reducciones significativas en prurito, urticaria y puntuación compuesta de actividad de la enfermedad ya desde la semana 1.
También se observaron mejoras rápidas y sostenidas en el angioedema, tanto en pacientes naïve a omalizumab como en aquellos con respuesta incompleta.
El beneficio clínico fue consistente en subgrupos de difícil tratamiento, como los pacientes con UCE tipo IIb, bajos niveles basales de IgE o eosinófilos, y prueba de BHRA positiva.
Aunque el número de pacientes en algunos subgrupos fue reducido, los hallazgos se alinean con la eficacia de otros inhibidores de BTK (BTKI), sugiriendo que rilzabrutinib podría representar una opción terapéutica útil en endotipos refractarios a los tratamientos disponibles.
Rilzabrutinib podría representar una opción terapéutica útil en endotipos refractarios a los tratamientos disponibles
El efecto clínico se correlacionó con reducciones en biomarcadores asociados a la UCE, incluyendo autoanticuerpos patogénicos (IgG anti-TPO y anti-FcεRI), así como descensos en sMRGPRX2 e IL-31, ambos vinculados con mayor severidad de la enfermedad y prurito. Estos resultados refuerzan la plausibilidad biológica del mecanismo de rilzabrutinib, que combina supresión de autoanticuerpos y modulación de mastocitos y basófilos, sin depleción de células B.
En cuanto a seguridad, rilzabrutinib mostró un perfil favorable, sin eventos adversos graves relacionados al fármaco ni toxicidades dependientes de la dosis. La mayoría de los efectos adversos fueron leves a moderados, y no se reportaron complicaciones clásicamente asociadas a otros BTKI, como citopenias, sangrado o fibrilación auricular.
Esta diferencia podría estar relacionada con la mayor selectividad y reversibilidad de rilzabrutinib, que minimiza efectos fuera del objetivo en comparación con inhibidores irreversibles previos.
Conclusiones
En conjunto, los hallazgos del ensayo aportan evidencia inicial de que rilzabrutinib es eficaz y seguro para todos los componentes clínicos de la UCE, incluidos los endotipos más complejos. Estos resultados se suman al creciente cuerpo de evidencia sobre BTKI de nueva generación en enfermedades inflamatorias no oncológicas.
La singularidad farmacológica de rilzabrutinib, como inhibidor covalente pero reversible, lo posiciona como un candidato con ventajas diferenciales dentro de esta clase terapéutica. No obstante, se requieren ensayos de mayor tamaño y seguimiento prolongado para confirmar la eficacia comparativa y caracterizar mejor su perfil de seguridad.
La singularidad farmacológica de rilzabrutinib lo posiciona como un candidato con ventajas diferenciales dentro de esta clase terapéutica
Urticaria: eficacia del rilzabrutinib
Fuente
Giménez-Arnau A, Ferrucci S, Ben-Shoshan M, et al. Rilzabrutinib in antihistamine-refractory chronic spontaneous urticaria. The RILECSU Phase 2 Randomized Clinical Trial. JAMA 2025; 2025;161;(7):679-687.