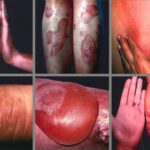
Estudio que analiza el rol de la colagenesa como principal agente en el desbridamiento enzimático de heridas
Lugones Editorial©
Las heridas crónicas pueden ser intensamente inflamatorias, por ejemplo, úlceras venosas, y por lo tanto producen cantidades sustanciales de exudado que interfieren con la curación o con la eficacia de los productos terapéuticos, como los factores de crecimiento y la piel de bioingeniería. En este sentido, en el contexto de la preparación del lecho de heridas, no solo hay que preocuparse por la eliminación de escaras reales y el tejido francamente no viable, sino también por el componente exudativo.
Además, hay una creciente conciencia de que las células residentes en heridas crónicas, por ejemplo, fibroblastos y queratinocitos, pueden ser fenotípicamente alteradas y dejar de responder a ciertas señales, incluidos los factores de crecimiento.
En el contexto de la preparación del lecho de heridas, algunos procedimientos cotidianos aparentemente básicos adquieren un nuevo significado. Por ejemplo, ante un desbridamiento quirúrgico en una úlcera neuropática del pie diabético, la herida está siendo extirpada, y en el proceso, el lecho de la herida se está quitando, así como el borde de la úlcera y el callo circundante. En forma simplista, en este caso, el desbridamiento está eliminando el tejido necrótico y disminuyendo la carga bacteriana. Sin embargo, hay una creciente conciencia de que se está logrando mucho más con este tipo de intervención quirúrgica.
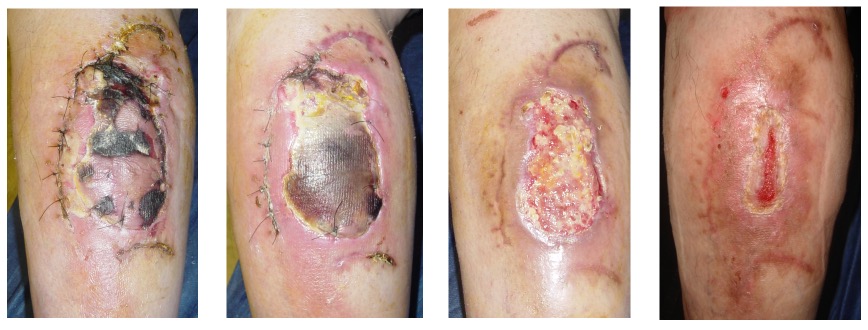
El desbridamiento enzimático de heridas consiste en la eliminación del tejido necrótico, a la vez que reduce la carga bacteriana. Imagen: gentileza Dr. Santiago Laborde
El rol de las enzimas
Da la casualidad de que los productos que contienen enzimas, anteriormente considerados principalmente como agentes desbridantes, han adquirido un nuevo significado dentro del contexto de la preparación del lecho de heridas.
Si bien el desbridamiento sin duda seguirá siendo una de las funciones críticas de los agentes desbridantes, sus otras propiedades y nuestra comprensión de lo que se necesita para optimizar la preparación para el cuidado de heridas tienen el potencial de expandir en gran medida sus beneficios terapéuticos.
Existe el potencial de que varios de los agentes enzimáticos se utilicen en el tratamiento de heridas, pero, solo dos de ellos, la papaína y la colagenasa, han tenido un papel sustancial y continuo para esta indicación.
Los autores centran su discusión en las proteinasas que comprenden cuatro grupos: Las proteinasas de serina tienen miembros muy conocidos en quimotripsina, tripsina, plasmina, activadores de plasminógenos y elastasas de leucocitos.
El segundo grupo de proteinasas son las cisteína proteinasas, y ciertamente la papaína es el miembro más conocido de este grupo y el mejor estudiado.
Las proteinasas aspárticas tienen una serie de enzimas bien conocidas, como la renina y la pepsina.
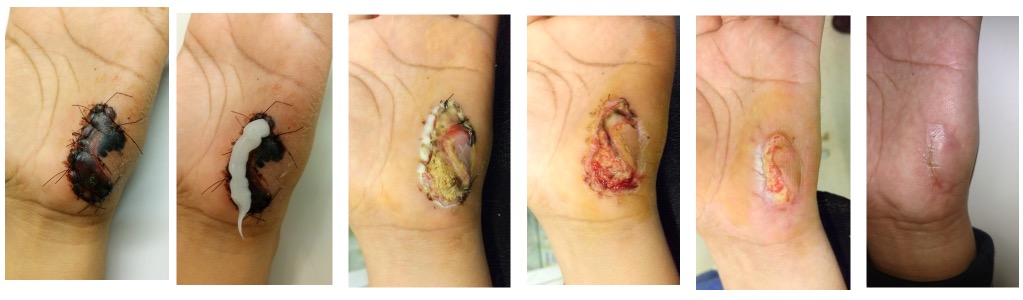
La extirpación del tejido necrótico es esencial para reducir la carga bacteriana, lo que a su vez disminuye la cantidad de exudado producido. Imagen: gentileza Dr. Santiago Laborde
Finalmente, las metaloproteinasas (MMP) son bien conocidas en el campo de la cicatrización de heridas debido a sus propiedades de poder escindir el colágeno y otros componentes de la matriz extracelular.
Para el propósito de la discusión sobre las colagenasas, las MMP más conocidas son MMP1 (colagenasa de fibroblastos), MMP2 (gelatinasa A), MMP8 (neutrofil collagenasa) y MMP9 (gelatinasa B). Muchas de estas peptidasas requieren cationes de zinc o calcio (o ambos) para su actividad. En algunos casos, el cobalto o el níquel pueden sustituirse por zinc sin pérdida de actividad. Además de su capacidad para escindir diferentes tipos de colágeno (colagenasas) y colágeno desnaturalizado (gelatinasas), algunos MMP pueden escindir otros sustratos, incluyendo elastina (MMP12), fibronectina y proteoglicanos (MMP10) y laminina (MMP3).
Las proteinasas son críticas para el proceso de reparación. La extirpación del tejido necrótico es esencial para reducir la carga bacteriana, lo que a su vez disminuye la cantidad de exudado producido.
Sin embargo, utilizando la colagenasa como prueba de principio, la actividad de la proteinasa en heridas crónicas no solo es útil para el propósito de desbridamiento, sino también para aspectos más fundamentales de la migración celular. En respuesta a la herida, los queratinocitos migran desde el borde de la herida y asumen un fenotipo colagenolítico. De hecho, se ha demostrado que la expresión de la colagenasa se induce rápidamente en los queratinocitos del borde de la herida, persiste durante la curación y se detiene en la reepitelización.
Además, la actividad de la colagenasa es necesaria para la migración de queratinocitos en una matriz de colágeno tipo I. Otros trabajos utilizando heridas de quemaduras humanas indican que tanto la colagenasa como su inhibidor, inhibidor tisular de las metaloproteinasas (TIMP), se expresan durante la reparación de la herida.
La colagenasa en el desbridamiento enzimático
El concepto de usar enzimas proteolíticas para digerir el tejido necrótico como complemento en el tratamiento de heridas complejas es bastante antiguo. Durante años la papaína se ha utilizado para el tratamiento de varias afecciones de la piel.
En este momento, dos preparaciones enzimáticas son bastante prominentes en términos de su uso en heridas crónicas: combinaciones a base de papaína-urea y colagenasa.
En relación a la colagenasa, es una preparación enzimática bien conocida y establecida utilizada para el desbridamiento. La colagenasa es una proteinasa soluble en agua que ataca y descompone específicamente el colágeno. Se ha demostrado que puede hidrolizar el colágeno nativo y, por lo tanto, facilitar el rápido desbridamiento y la curación de heridas crónicas. Su mecanismo de acción consiste en degradar el colágeno y convertirlo en gelatina, sobre la que pueden actuar enzimas menos específicas.
¿Cómo entra la colagenasa en el tejido necrótico y, por lo tanto, ayuda en el desbridamiento? Una hipótesis es que la colagenasa puede escindir las moléculas de colágeno en el límite del tejido necrótico, liberando así el tejido necrótico de la herida. Por lo tanto, se ha demostrado que el tejido necrótico está anclado a la herida por hebras de colágeno no natural.
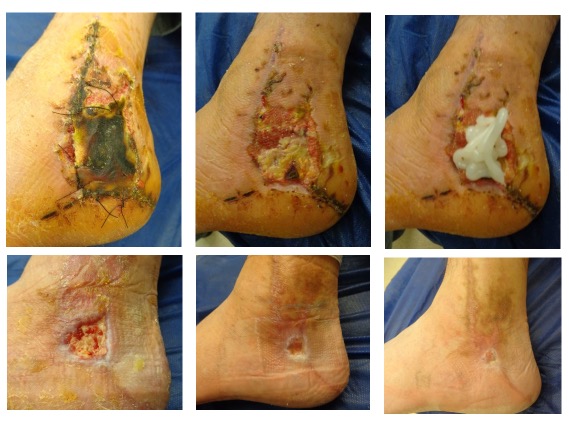
Se ha demostrado que la colagenasa puede hidrolizar el colágeno nativo y, por lo tanto, facilitar el rápido desbridamiento y la curación de heridas crónicas. Imagen: gentileza Dr. Santiago Laborde
Se ha descubierto que la colagenasa es notablemente suave con las células viables. Por ejemplo, las suspensiones celulares preparadas con colagenasa, luego almacenadas a baja temperatura, se encontraron iguales a las células tripsinizadas en su viabilidad y crecimiento. Del mismo modo, la colagenasa se puede utilizar como un ingrediente permanente de los medios de cultivo sin pérdida de viabilidad celular.
A diferencia de la papaína, la colagenasa puede funcionar un poco más lentamente, pero es un sistema enzimático más selectivo. Incluso es más probable que la colagenasa sea útil durante un período de tiempo muy prolongado en la herida en lo que se llama desbridamiento de mantenimiento.
Asimismo, las preparaciones a base de colagenasa pueden estimular el tejido de granulación y posiblemente la angiogénesis, y existe una razón considerable para querer usar la colagenasa en heridas con el fin de mejorar o acelerar la reepitelización. Por ende, la colagenasa se utiliza como un posible agente de preparación del lecho de heridas “pluripotencial” al cortar el colágeno en el borde del tejido viable y necrótico, liberando así el tapón necrótico para una fácil extracción. Al mismo tiempo, la presencia de colagenasa aplicada exógenamente puede estimular directamente el proceso de reepitelización de la herida.
Estudio sobre el desbridamiento enzimático de heridas
Fuente
Wound bed preparation and the role of enzymes: a case for multiple actions of therapeutic agents.