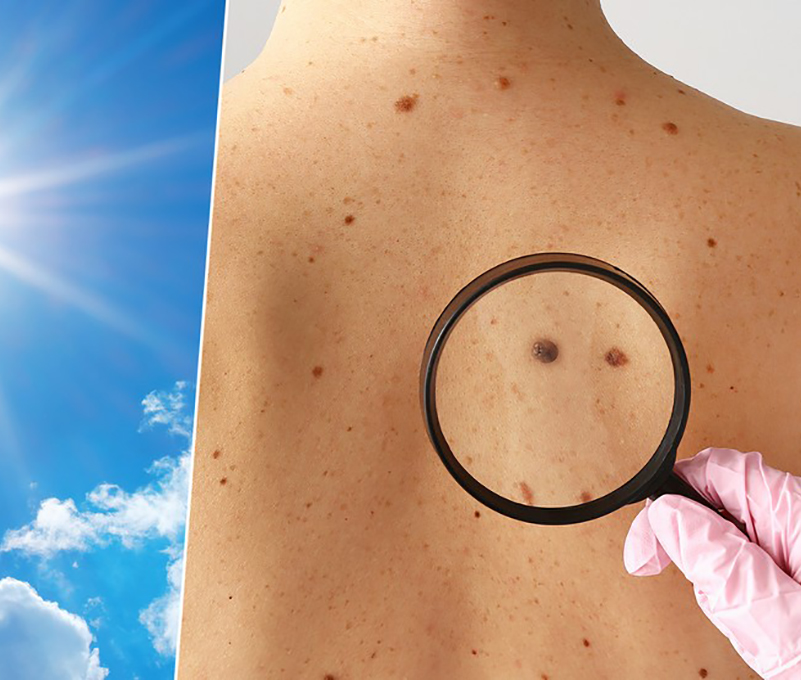
Revisión que examina cómo los rayos UV generan estrés oxidativo y mutaciones características que impulsan la iniciación y progresión del melanoma
Lugones Editorial©
Una extensa investigación sobre la patogénesis del melanoma identifica a los rayos UV como el factor más importante en la transformación melanocítica. Los efectos oxidativos de la irradiación UV ejercen su influencia en la patogénesis del melanoma, principalmente a través de la modificación de ácidos nucleicos, proteínas y lípidos, interrumpiendo aún más la señalización celular y la regulación del ciclo celular.
Sus efectos se extienden más allá de los melanocitos, lo que lleva a la inmunosupresión en el tejido de la piel expuesto, lo que en consecuencia crea condiciones para la evasión de la vigilancia inmune y una mayor progresión.
El melanoma cutáneo representa la mayoría de las muertes relacionadas con el cáncer de piel, y su incidencia aumenta cada año
En esta revisión, los autores se centran en los cambios moleculares específicos inducidos por los rayos UV y sus consecuencias biológicas en el melanoma, aunque el papel exacto del estrés oxidativo varía según el contexto celular. Comprender estos mecanismos ofrece oportunidades para identificar posibles objetivos de prevención y tratamiento.
Resumen gráfico
Acerca del melanoma
El melanoma cutáneo es la forma más agresiva de cáncer de piel, con rápida progresión y alto potencial metastásico, afectando principalmente a individuos de piel clara. Su desarrollo está vinculado a múltiples factores de riesgo, siendo la exposición a los rayos UV el más relevante, junto con inmunosupresión y presencia de múltiples nevos.
Los melanocitos, células productoras de pigmento distribuidas en la piel y otros tejidos, son la célula de origen del melanoma. Además de proteger contra la radiación UV, participan en la inmunidad innata. Aunque predominan los melanomas cutáneos, existen subtipos menos frecuentes como los melanomas oculares, mucosos y subunguales, que suelen tener peor pronóstico.
Los melanocitos, células productoras de pigmento distribuidas en la piel y otros tejidos, son la célula de origen del melanoma
Entre los melanomas cutáneos, los principales subtipos histológicos incluyen melanoma de propagación superficial (SSM), lentigo maligno (LMM), lentiginoso acral (ALM), desmoplásico (DM) y nodular (NM), con diferencias en pronóstico y mutaciones genéticas asociadas. La señalización celular alterada en respuesta a factores cancerígenos, incluyendo los rayos UV, es clave en la patogénesis y guía la prevención y el tratamiento dirigido.
La exposición prolongada a la radiación UV induce estrés oxidativo en los melanocitos, alterando el equilibrio redox y promoviendo mecanismos de transformación neoplásica.
Epidemiología y clasificación del melanoma
El melanoma surge principalmente por mutaciones inducidas por la radiación UV en los melanocitos, además de factores genéticos heredados. Según la ubicación y la exposición al sol, se clasifica en melanoma de alto daño solar crónico (CSD alto), bajo daño solar crónico (CSD bajo) y subtipos no solares.
- El CSD alto incluye LMM y DM, localizados en cabeza, cuello y extremidades distales, y afecta sobre todo a adultos mayores de 55 años, con alta frecuencia de mutaciones en NF1, NRAS, KIT y BRAF.
- El CSD bajo, principalmente SSM, afecta áreas con exposición solar esporádica, como el tronco, y suele diagnosticarse en pacientes más jóvenes, con mutaciones BRAF V600E predominantes.
A pesar del uso de protectores solares como estrategia preventiva, la incidencia de melanoma sigue aumentando, posiblemente por reaplicación insuficiente, sobreexposición solar y mayor detección de casos.
La utilización de camas solares también incrementa el riesgo, especialmente de melanomas de inicio temprano. Estos hallazgos refuerzan la necesidad de educación sobre la exposición a rayos UV y el uso correcto de fotoprotección.

A pesar del uso de protectores solares, la incidencia de melanoma sigue aumentando, posiblemente por reaplicación insuficiente, sobreexposición solar y mayor detección de casos
Vías moleculares en la melanomagénesis afectadas por radiación UV
La radiación UV contribuye a la melanomagénesis al desregular múltiples vías de señalización en los melanocitos, entre ellas MAPK, NRAS, BRAF, PI3K-AKT, NFκB y MITF. Las mutaciones BRAF V600E y NRAS Q61R son frecuentes y promueven proliferación, crecimiento tumoral y evasión inmune.
La vía MAPK es central en la transformación melanocítica, y la inhibición combinada de BRAF y MEK ha mejorado la supervivencia de pacientes, aunque la resistencia terapéutica persiste.
Otros reguladores importantes incluyen c-KIT, GNAQ/GNA11, MC1R, TYR y OCA2, que afectan la pigmentación y la señalización celular. La vía PI3K-AKT se activa por pérdida de PTEN o sobreexpresión de AKT, promoviendo carcinogénesis. Mutaciones en CDKN2A y vías asociadas a RB, CCND1 y CDK4/6 facilitan la progresión del ciclo celular, especialmente en melanomas acrales.
Vías adicionales como HIF, Notch, Wnt y NFκB contribuyen a la red compleja de señalización desregulada, regulando proliferación, diferenciación y metástasis. La interacción entre estas rutas y la respuesta al estrés oxidativo inducido por UV ofrece oportunidades para nuevos enfoques terapéuticos y estrategias de prevención.
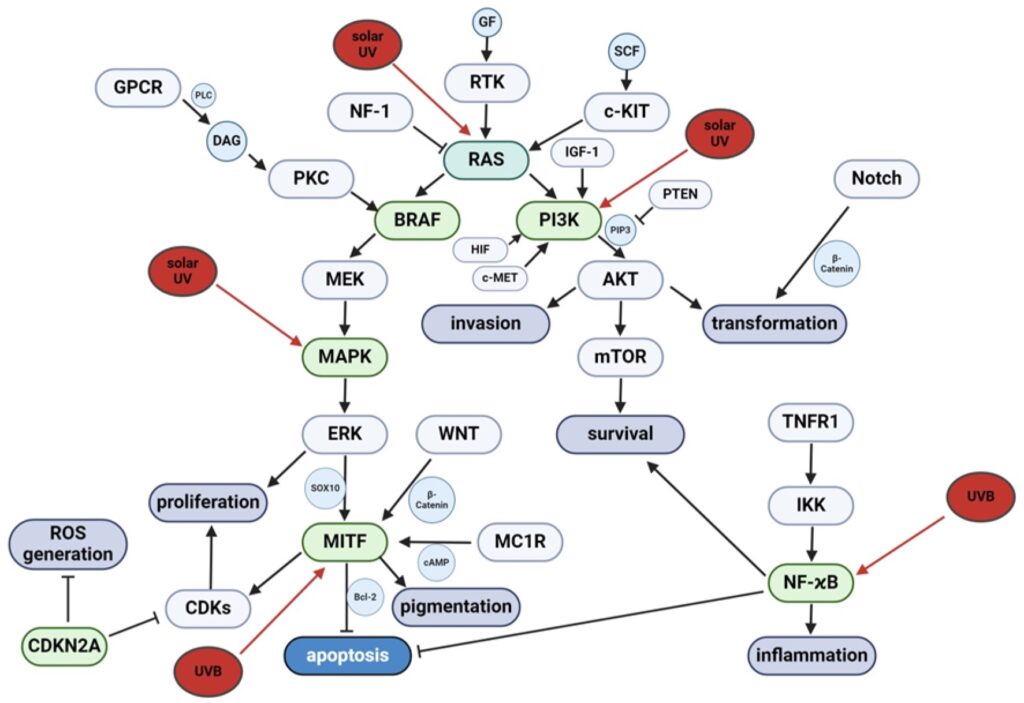
Las vías de señalización molecular más importantes activadas por la irradiación UV y su participación en la patogénesis del melanoma
Desarrollo del melanoma dependiente de los rayos UV
La radiación UV influye en la melanomagénesis de manera multifacética. El UVB (280-315 nm) daña directamente el ADN, promoviendo dímeros de pirimidina y mutaciones características como transiciones C>T, mientras que el UVA (315-400 nm) penetra más profundo, genera especies reactivas de oxígeno (ROS) y causa daño indirecto al ADN, especialmente mediado por feomelanina.
Ambos tipos de radiación alteran los mecanismos de reparación del ADN, incluyendo NER y BER, favoreciendo la acumulación de mutaciones en melanocitos.
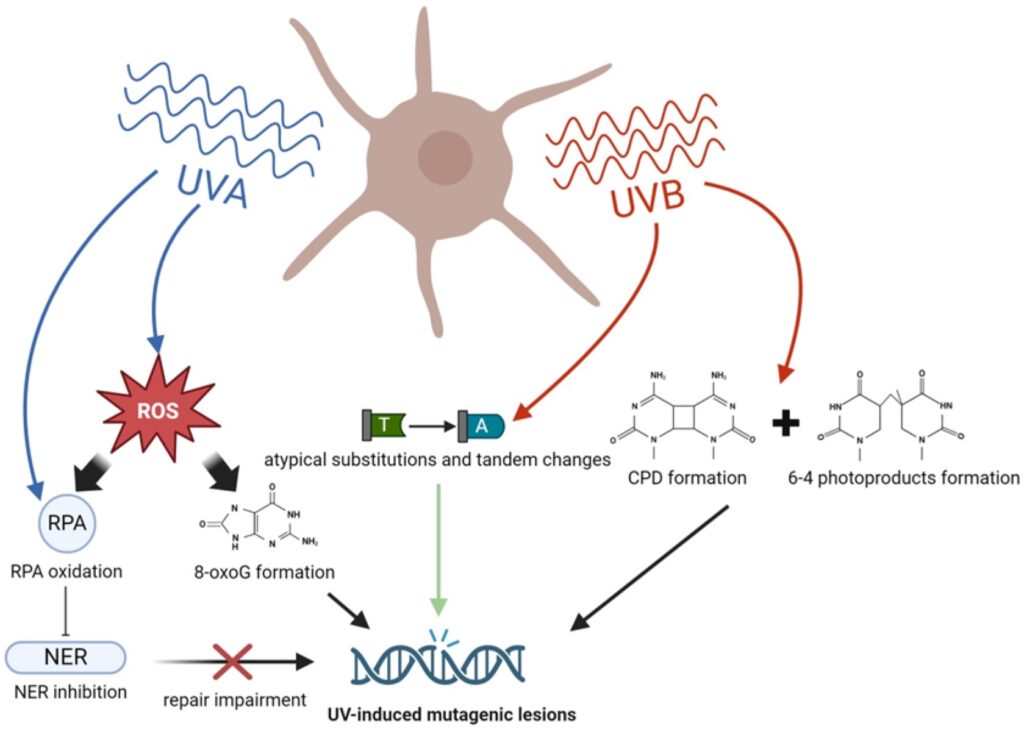
Mecanismos de formación de lesiones mutagénicas inducidas por los rayos UV en los melanocitos
Además, la radiación UV modula el sistema inmunológico: induce inmunosupresión local y sistémica mediante queratinocitos, células de Langerhans, linfocitos T reguladores y microvesículas, afectando la vigilancia inmune y promoviendo un microambiente favorable para la progresión tumoral.
También genera estrés oxidativo, inflamación y degradación de la matriz extracelular, facilitando la invasión y la heterogeneidad tumoral.
En conjunto, estos efectos mutagénicos, inmunomoduladores y metabólicos explican cómo la exposición crónica a los rayos UV impulsa la iniciación y progresión del melanoma, mientras que la inmunomodulación y la heterogeneidad intratumoral influyen en la respuesta a terapias como los inhibidores de puntos de control inmunitario.
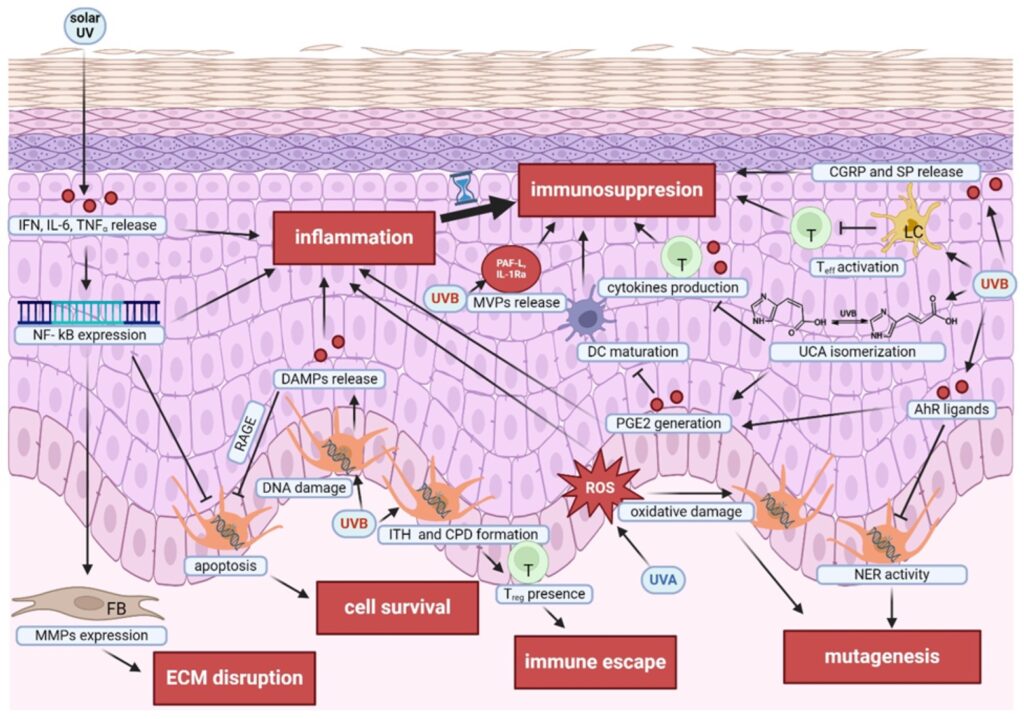
Los efectos de la radiación UV que conducen al desarrollo de melanoma
Estado redox en la iniciación y posterior desarrollo del melanoma
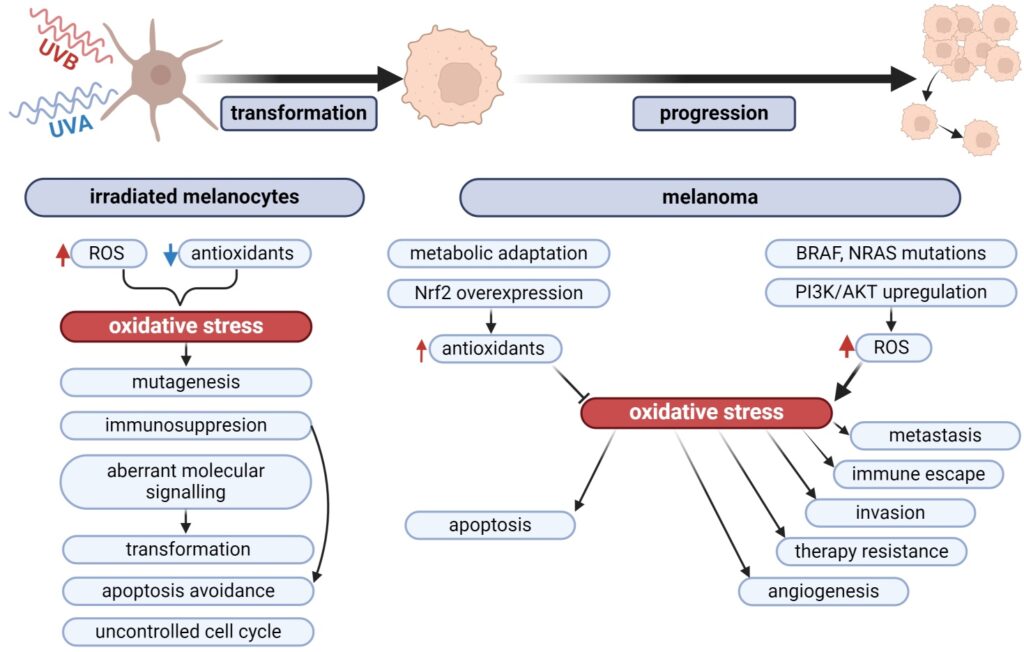
El equilibrio redox es determinante en la iniciación y progresión del melanoma. Los niveles elevados de especies reactivas de oxígeno (ROS) inducen estrés oxidativo, causando daño al ADN, mutaciones y alteraciones en vías de señalización que promueven proliferación, supervivencia celular, angiogénesis y evasión inmune.

Diferencias en el estado redox a lo largo del curso de la melanomagénesis
- El impacto de la melanina y la melanogénesis en la homeostasis redox de los melanocitos
La biosíntesis de melanina genera ROS, exacerbando un entorno prooxidativo en melanocitos, especialmente aquellos con mayor feomelanina, que son más susceptibles a daño oxidativo.
La radiación UVB induce iNOS y NOX1, promoviendo feomelanogénesis y aumentando el riesgo de melanoma desde nevos displásicos.
Algunos fármacos, como fluoroquinolonas y tetraciclinas, potencian la fototoxicidad y el estrés oxidativo mediado por melanina.
- La contribución del estrés oxidativo al inicio del melanoma
Los melanocitos son más vulnerables al daño oxidativo por UVA/UVB debido a la actividad reducida de antioxidantes como CAT, SOD y GPX.
La deficiencia de CDKN2A y la mutación de p16 intensifican el estrés oxidativo, favoreciendo mutaciones no letales que conducen a transformación neoplásica, mientras que niveles basales de actividad antioxidante permiten la supervivencia de células dañadas.
- El impacto del estrés oxidativo en la melanomagénesis
La exposición prolongada a UV altera el equilibrio redox hacia un estado prooxidante, promoviendo proliferación, evasión de apoptosis (anoikis) e hipermetilación de ADN.
ROS elevados aumentan agresividad, angiogénesis (VEGF, sFRP2), invasión y heterogeneidad tumoral. Afectan ADN, ARN y proteínas, generando mutaciones, alteración epigenética y oxidación proteica, incluyendo productos finales de glicación avanzada (AGE) que activan RAGE y contribuyen a inflamación y supresión inmune.
ROS también modulan vías clave como MAPK, PI3K/AKT, NF-κB y Nrf2, influyendo en supervivencia y resistencia a terapias.
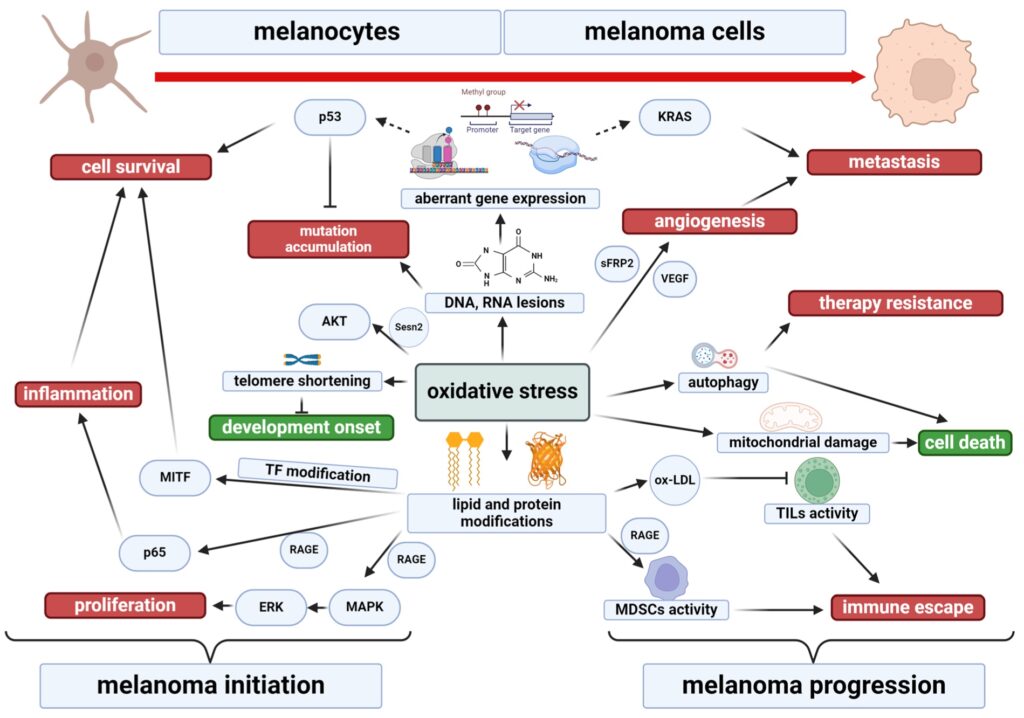
El impacto del estrés oxidativo en la melanomagénesis. TF—factor de transcripción
- El estado del equilibrio redox en las células del melanoma
Las células de melanoma mantienen la generación de ROS mediante NOX y NOS, mientras activan sistemas antioxidantes dependientes de Nrf2 (HO-1, NQO1, SOD, GSH, TRX/TrxR, SRXN) para sobrevivir y proliferar. La cooperación entre Nrf2 y NF-κB regula inflamación, angiogénesis y progresión tumoral.
El estrés oxidativo también afecta metabolismo de carbohidratos (vía pentosa-fosfato y serina), lípidos (peroxidación de PUFA, eicosanoides) y endocannabinoides, modulando el microambiente tumoral y la melanomagénesis.
Conclusiones
La melanomagénesis es un proceso heterogéneo impulsado principalmente por la radiación UV, que induce estrés oxidativo, daño al ADN, inmunosupresión y alteraciones de la ECM en los melanocitos.
El estrés oxidativo contribuye significativamente al inicio de la transformación neoplásica, aunque su papel exacto en la progresión del melanoma es complejo debido al delicado equilibrio entre ROS/RNS y sistemas antioxidantes en las células malignas.
La sobreexpresión de proteínas prooxidantes facilita proliferación, invasión, metástasis y resistencia terapéutica, mientras que la regulación de antioxidantes dependientes de Nrf2 y los cambios metabólicos hacia la regeneración antioxidante representan mecanismos protectores.
Esto indica que un entorno prooxidante puede favorecer la transformación inicial, pero al mismo tiempo, modular el avance de la enfermedad.
Las adaptaciones metabólicas observadas sugieren que los moduladores del equilibrio redox, incluidos prooxidantes, podrían usarse estratégicamente en terapias de melanoma para superar resistencia y promover apoptosis.
Comprender estos mecanismos multidireccionales es crucial para desarrollar nuevas estrategias terapéuticas y mejorar la supervivencia de los pacientes.
Las adaptaciones metabólicas observadas sugieren que los moduladores del equilibrio redox, incluidos prooxidantes, podrían usarse estratégicamente en terapias de melanoma para superar resistencia y promover apoptosis
Melanoma y rayos UV
Fuente
Gieniusz E, Skrzydlewska E, Łuczaj W. Current insights into the role of UV radiation-induced oxidative stress in melanoma pathogenesis. Int J Mol Sci 2024;25(21).