Novedoso estudio que demuestra cómo variantes genéticas comunes influyen en el riesgo y la forma de presentación de la diabetes monogénica
Lugones Editorial©
En este artículo los autores intentan demostrar que el trasfondo poligénico da forma sustancial a la presentación clínica de la diabetes de inicio de la madurez de los jóvenes (madurity onset diabetes in young, MODY), una forma monogénica común de diabetes que generalmente se presenta en la adolescencia o en la edad adulta temprana.
Hallaron un fuerte enriquecimiento del riesgo poligénico de diabetes tipo 2 (DM2), pero no del riesgo de DM1, en casos de MODY confirmados genéticamente (n=1.462).
Esta carga poligénica de DM2, principalmente a través de las vías de disfunción de las células beta, está fuertemente asociada con una edad temprana de diagnóstico y un aumento de la gravedad de la DM.
Las variantes genéticas comunes representan colectivamente el 24% de la variabilidad fenotípica.
Se halló un fuerte enriquecimiento del riesgo poligénico de diabetes tipo 2, pero no del riesgo de diabetes tipo 1, en casos de MODY confirmados genéticamente
Diabetes MODY
Las enfermedades monogénicas se definen clásicamente por mutaciones causales únicas y altamente penetrantes (proporción de portadores que desarrollan la enfermedad). Sin embargo, muchos individuos que son portadores de la misma variante patógena muestran una amplia variación en la expresión de la enfermedad, lo que sugiere que factores adicionales influyen en el riesgo de enfermedad.
Respecto del análisis de las mutaciones patógenas de HNF1A, típicamente asociadas con la diabetes de inicio joven, los autores hallaron diferencias sorprendentes en la penetrancia: más del 90% en cohortes clínicamente determinadas frente a menos del 30 % en cohortes poblacionales a la edad de 40 años.
La diabetes MODY sirve como un excelente modelo de enfermedad genética para investigar cómo las variantes genéticas comunes influyen en la enfermedad monogénica de inicio joven. MODY es la forma autosómica dominante más común de diabetes monogénica que contribuye hasta el 3% de toda la diabetes menor de 30 años.
La diabetes MODY sirve como un excelente modelo de enfermedad genética para investigar cómo las variantes genéticas comunes influyen en la enfermedad monogénica de inicio joven
- En este estudio los autores se centraron en los genes HNF1A, HNF4A y HNF1B (denominados colectivamente como HNF-MODY). Las variantes patógenas en estos tres genes representan >90% de los casos de MODY.
- Investigaron la interacción entre los antecedentes poligénicos y los trastornos monogénicos dependientes de la edad, utilizando MODY como modelo de enfermedad.
- En la cohorte de MODY más grande estudiada hasta la fecha, demostraron que las variantes genéticas comunes explican una proporción sustancial de la variación fenotípica, la expresión de la enfermedad y pueden explicar los fenotipos similares a los MODY en individuos sin causas monogénicas identificadas.
Resultados
Carga poligénica de la diabetes tipo 2
- Contribución principal del DM2 PGS. El PGS de DM2 se identificó como el contribuyente más fuerte al riesgo de enfermedad (OR 1,46; IC 95% 1,36–1,58; P < 0,0001), incluso tras considerar otras puntuaciones poligénicas. Este enriquecimiento fue menor que el observado en DM2 y se mantuvo independiente de los antecedentes familiares y tras la exclusión de variantes en los genes HNF1A, HNF4A o HNF1B, lo que sugiere un efecto adicional de las variantes comunes sobre la expresión clínica de la enfermedad.
- Vías T2D implicadas. El análisis de PGS específicos de vías DM2 mostró que las más relevantes en pacientes con MODY fueron aquellas relacionadas con síndrome metabólico, glucémico residual y proinsulina de células beta, con aumentos de 0,16–0,20 desviaciones estándar y significancia estadística elevada (P < 4 × 10^-8). Esto permite identificar mecanismos moleculares específicos a través de los cuales las variantes comunes contribuyen al fenotipo de MODY.
- Interacción entre variantes raras y comunes. Se evidenció una interacción significativa entre la severidad de la variante patógena y la carga poligénica de DM2. Pacientes portadores de variantes missense menos dañinas presentaron un mayor efecto del PGS, mientras que aquellos con variantes truncantes más perjudiciales mostraron menor influencia de las variantes comunes. Estos hallazgos indican que las variantes comunes modulan de manera sustancial la expresión clínica del HNF-MODY, en combinación con la mutación monogénica.
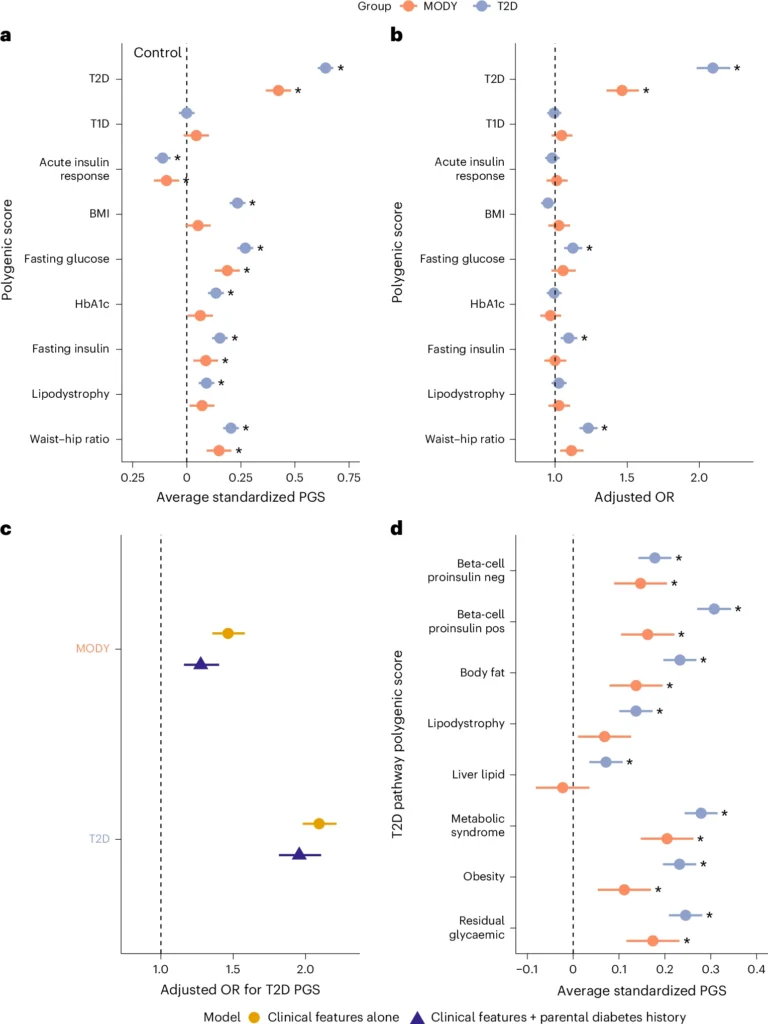
Riesgo poligénico elevado en la diabetes monogénica con HNF
Aumento de la carga poligénica
- Carga poligénica y edad de diagnóstico. En pacientes con HNF-MODY, solo la carga poligénica de DM2 (DM2 PGS) mostró una asociación significativa con la edad al diagnóstico, incluso después de ajustar por otras puntuaciones poligénicas. Cada aumento de 1 desviación estándar en DM2 PGS se relacionó con un diagnóstico aproximadamente 1,2 años más temprano. Este efecto se vio impulsado principalmente por la vía positiva para la proinsulina de células beta, indicando que mecanismos específicos de secreción de insulina influyen en la aparición temprana de la enfermedad.
- Carga poligénica y gravedad de la diabetes. La DM2 PGS y la puntuación de IMC PGS se asociaron con una mayor gravedad de la diabetes, definida como necesidad de insulina o HbA1c ≥ 8,5%. Los odds ratios fueron 1,24 y 1,32, respectivamente, siendo la vía de la obesidad la que mostró la asociación más fuerte con la gravedad clínica. El IMC PGS también se correlacionó de manera significativa con el IMC medido de los pacientes, confirmando la consistencia de los hallazgos.
- Influencia de factores clínicos y genéticos. Los efectos de la DM2 PGS sobre la edad de diagnóstico y la gravedad se mantuvieron tras ajustar por características clínicas y etiología genética.
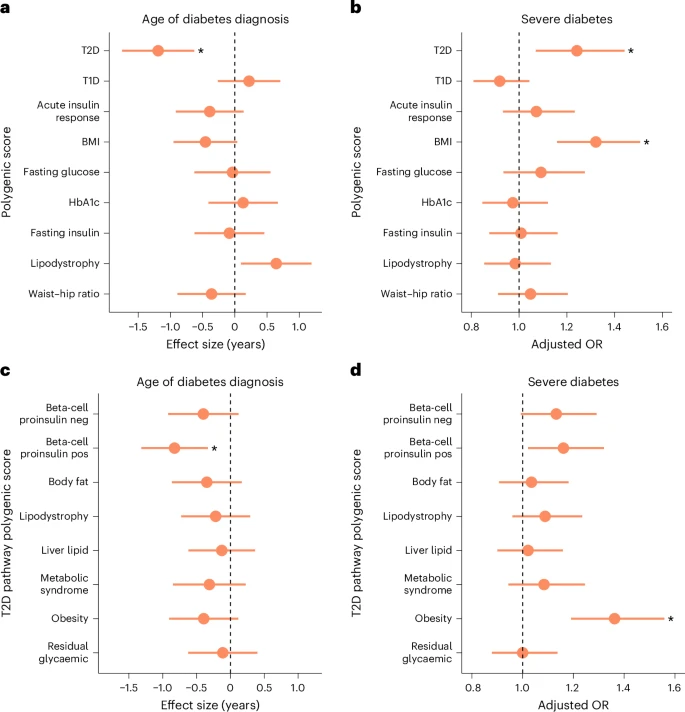
Aumento del riesgo poligénico asociado con un diagnóstico de diabetes más temprano y más grave en HNF-MODY.
Influencia de la carga poligénica de la diabetes tipo 2
- Impacto del trasfondo poligénico en portadores no seleccionados clínicamente. Para evaluar cómo la carga poligénica de DM2 influye en el riesgo de diabetes en portadores de variantes patógenas de HNF-MODY, se analizaron 424.553 individuos europeos del Biobanco del Reino Unido sin selección clínica previa. Entre ellos, 100 portadores de mutaciones en HNF1A, HNF4A o HNF1B fueron identificados. Esto permitió observar el efecto puro del trasfondo poligénico sobre la penetrancia de la enfermedad.
- Variación del riesgo según DM2 PGS. El riesgo de desarrollar diabetes varió ampliamente según el DM2 PGS. A)Portadores en el quintil más bajo de DM2 PGS: riesgo 8,5 veces mayor que no portadores intermedios. B) Portadores en el quintil más alto de DM2 PGS: riesgo 40,2 veces mayor. C) En general, el riesgo osciló entre 11,4 % y 81,7 % a lo largo de todo el rango de DM2 PGS. Esto evidencia que el trasfondo poligénico modula de manera considerable la expresión clínica de HNF-MODY.
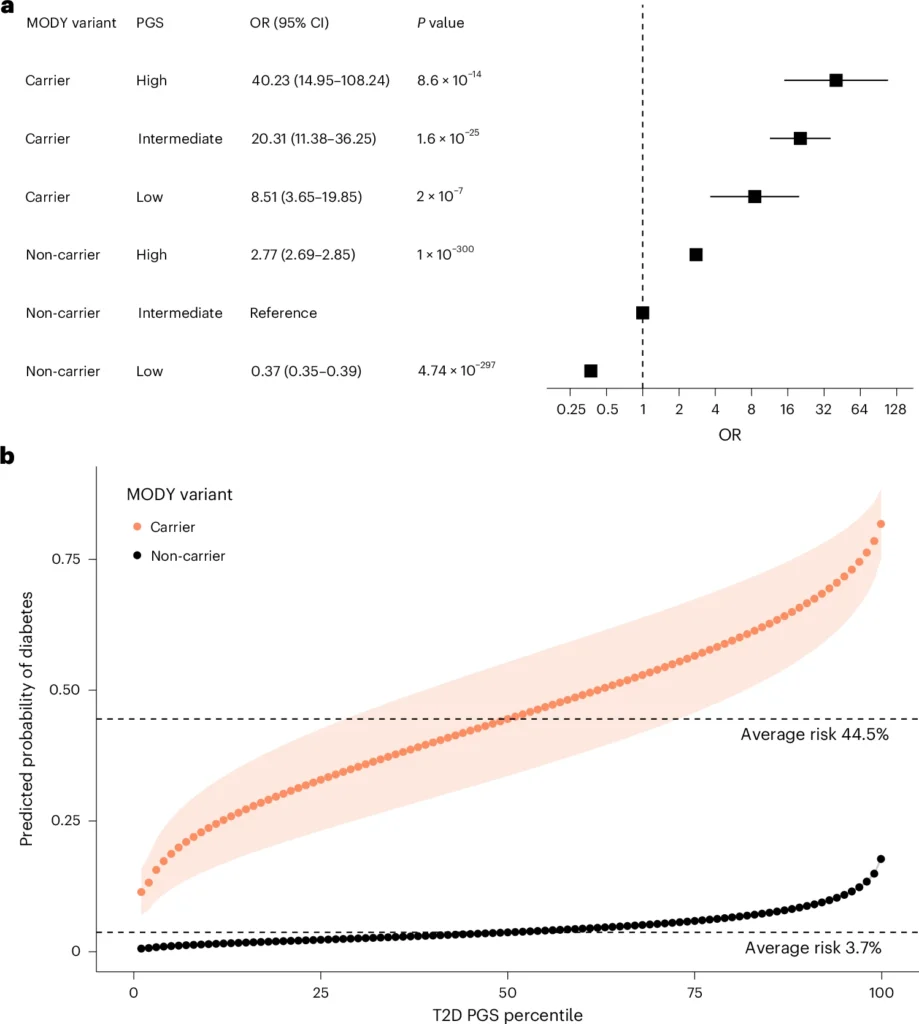
El fondo poligénico modifica el riesgo de diabetes en portadores de HNF-MODY clínicamente no seleccionados.
Variantes genéticas comunes
- Contribución de variantes comunes a MODY. Para cuantificar el efecto global de las variantes genéticas comunes, se utilizó análisis de rasgos complejos del genoma (GCTA-GREML) en pacientes con HNF-MODY. Se estimó que la heredabilidad atribuible a SNPs comunes fue de 23,9 % (IC 95 % 17,2–30,7 %; P < 0,0001), lo que indica que casi un cuarto de la varianza fenotípica en MODY se debe a variantes comunes. Esta cifra es solo ligeramente menor que la heredabilidad estimada para DM2 poligénica (30,8 %).
- Consistencia de los hallazgos. La estimación de la heredabilidad se mantuvo consistente usando diversos métodos y subgrupos. Esto refuerza la solidez de que las variantes comunes tienen un papel sustancial en MODY, más allá de la mutación monogénica específica.
- Interacción con variantes de DM2. Al comparar la herencia de SNP en MODY con casos de DM2 y ajustar por el DM2 PGS, la heredabilidad disminuyó al 17,2 %, lo que indica que aproximadamente un tercio de la influencia de variantes comunes en MODY proviene de variantes asociadas a DM2. El resto sugiere la existencia de modificadores genéticos independientes de DM2, que contribuyen a la presentación clínica de HNF-MODY.
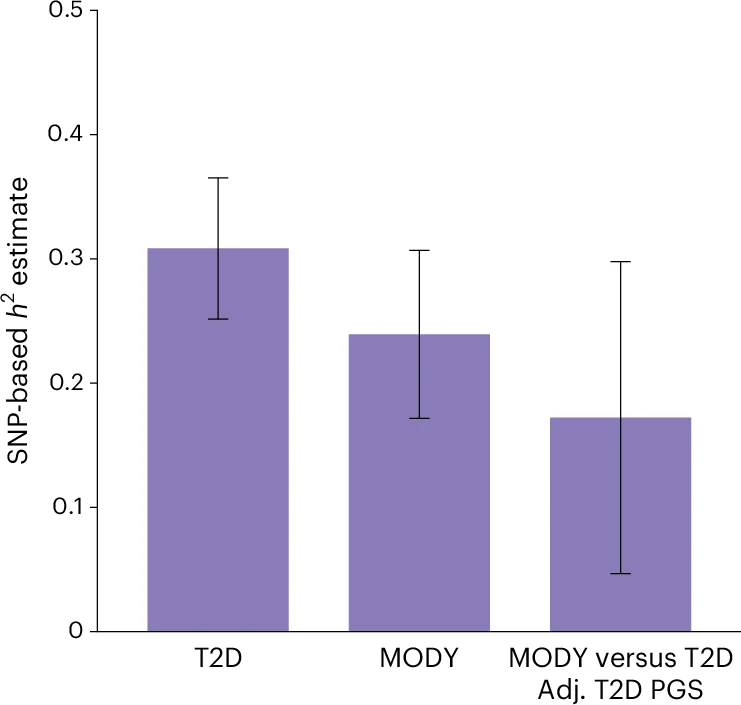
Estimaciones de heredabilidad basadas en SNP para MODY.
MODY clínicamente referidos sin variante patógena
Se estudiaron 300 individuos con fenotipo MODY (diagnóstico <30 años, IMC <30, sin evidencia de T1D) que resultaron negativos para mutaciones monogénicas conocidas. La edad de diagnóstico e IMC fueron similares a los casos MODY positivos para mutación, indicando un fenotipo comparable.
- Enriquecimiento poligénico de DM2 y rasgos relacionados. Estos casos no resueltos mostraron una DM2 PGS 1,18 s.d. más alta que controles (P < 0,0001), mayor incluso que los MODY positivos para mutación (0,73 s.d.) y los casos de DM2 (0,52 s.d.). También presentaron exceso de PGS de IMC y relación cintura-cadera. El enriquecimiento más marcado se observó en la vía de proinsulina de células beta (+0,62 s.d.).
- Interpretación: fenocopias poligénicas. El exceso de antecedentes de diabetes biparental (53 % un padre, 15,7 % ambos padres con diabetes) apoyó la idea de un enriquecimiento poligénico notable. Estos hallazgos sugieren que, aunque algunos casos podrían ocultar nuevas mutaciones monogénicas, muchos representan fenocopias poligénicas impulsadas por una alta carga de variantes comunes de DM2 y rasgos metabólicos asociados.
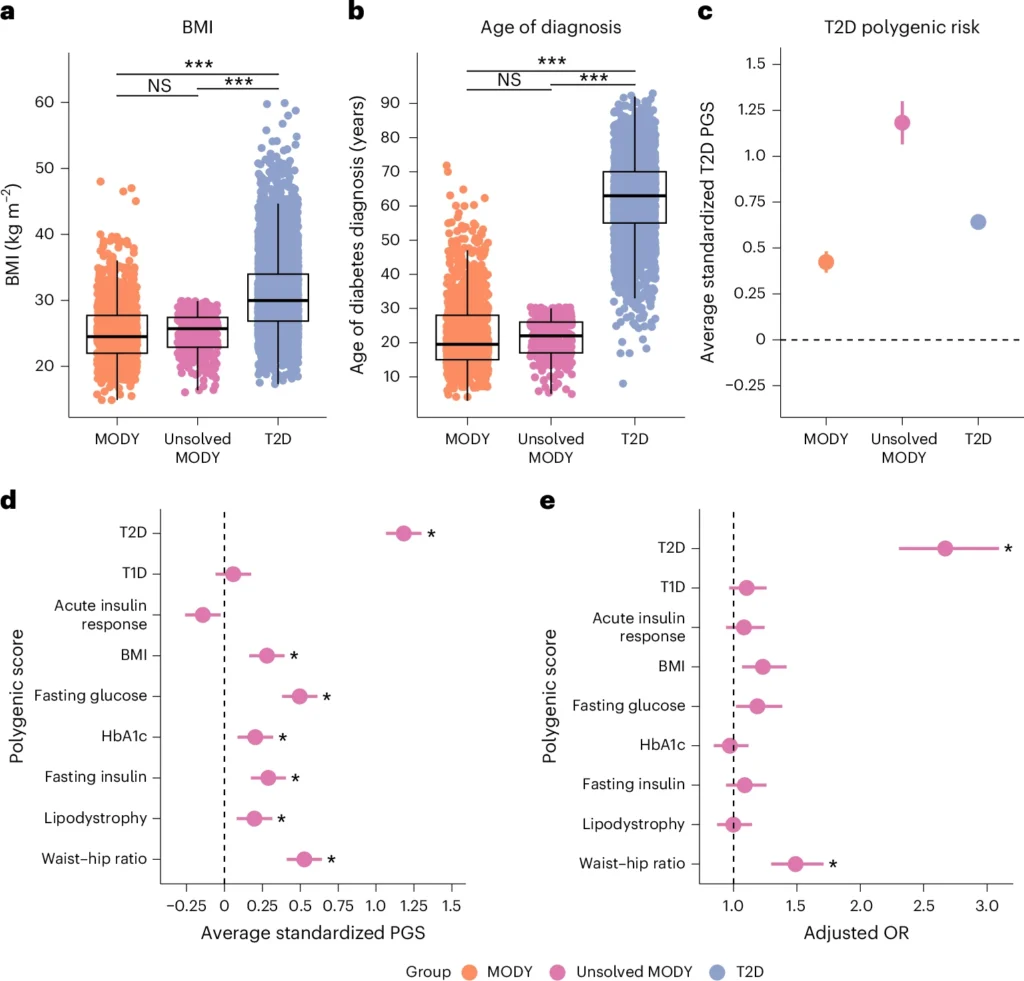
Los casos de MODY no resueltos exhiben un riesgo poligénico extremo de T2D, mientras que fenotípicamente se asemejan a los casos típicos de MODY.
Discusión
- Componente poligénico en HNF-MODY. HNF-MODY, aunque considerado un trastorno monogénico, tiene un componente poligénico significativo que influye en la edad de inicio y la gravedad clínica. La carga poligénica de DM2 también puede explicar los fenotipos MODY sin mutaciones conocidas.
- Contribución de variantes comunes. Las variantes comunes explican aproximadamente el 24 % de la varianza fenotípica, cercana a la de DM2, con el mayor efecto proveniente de las vías de células beta/proinsulina. No se observó interacción con el riesgo de T1D, confirmando la distinción entre mecanismos autoinmunes y MODY.
- Modulación del riesgo por fondo poligénico. El riesgo poligénico de DM2 modifica la penetrancia de las mutaciones HNF-MODY: portadores con bajo riesgo poligénico tienen menor probabilidad de desarrollar diabetes, mientras que casos no resueltos pueden representar fenocopias poligénicas impulsadas por alta carga poligénica y posibles variantes raras.
- Modelo de riesgo y predicción clínica. MODY ilustra que los trastornos monogénicos existen en un continuo, donde la combinación de mutaciones y fondo poligénico determina la expresión clínica. La predicción de riesgo futura deberá integrar factores monogénicos, poligénicos y ambientales para mejorar diagnóstico y estratificación clínica.
Conclusiones
El estudio demuestra que la patogénesis de MODY implica una interacción sustancial entre variantes monogénicas y poligénicas. Los futuros enfoques de predicción y manejo clínico deberán considerar esta interacción, integrando información genética completa y factores ambientales para mejorar la estratificación de riesgo y utilidad clínica.

La diabetes MODY implica una interacción sustancial entre variantes monogénicas y poligénicas
Diabetes monogénica: novedades 2025
Fuente
Leech JM, Beaumont RN, Arni AM, et al. Common genetic variants modify disease risk and clinical presentation in monogenic diabetes. Nature 2025;7.









