Evaluación clínica, selección de pruebas genéticas y tecnologías de secuenciación son algunos temas de esta segunda parte de la guía para especialistas en dermatología
Lugones Editorial©
En esta segunda parte, los autores brindan un esquema para la evaluación clínica, cómo elegir la prueba genética más adecuada para las diferentes presentaciones en dermatología y examinan las indicaciones para pruebas de un solo gen, paneles de genes, exoma completo y secuenciación del genoma completo.
También, profundizan acerca de las tecnologías de secuenciación, incluida la secuenciación de próxima generación (NGS) y sus diversas plataformas.
Al comprender estas tecnologías, los médicos estarán mejor equipados para interpretar los resultados de las pruebas con precisión y colaborar con consejeros genéticos y expertos de laboratorio de manera efectiva.
Las tecnologías de secuenciación genómica han revolucionado el enfoque diagnóstico de las genodermatosis
Introducción
Las genodermatosis incluyen todos los trastornos hereditarios de la piel, siendo los de un solo gen el grupo más grande. La llegada de la secuenciación de próxima generación (NGS) ha transformado el diagnóstico, convirtiéndose en práctica rutinaria en entornos clínicos. Sin embargo, muchos dermatólogos carecen de conocimiento profundo sobre las tecnologías de detección de mutaciones y la interpretación de los informes genéticos.
Esta segunda parte se centra en trasladar los conceptos básicos de genética de la parte 1 a la evaluación clínica, selección de pruebas genéticas y aplicación práctica en dermatología, para mejorar la comprensión de metodologías de secuenciación y la interpretación de resultados en el manejo de pacientes y familias.
Pasos en la detección genética de genodermatosis
Historia y examen
Los dermatólogos deben identificar signos de alerta (“red flags”) que sugieran genodermatosis, como: eritrodermia, bebé colodiónico, ampollas al nacimiento, eccema resistente, queratodermia palmoplantar, fotosensibilidad, poiloderma, múltiples tumores cutáneos, lesiones lineales o segmentarias, máculas hipo/hiperpigmentadas, piel laxa, antecedentes familiares positivos y otras manifestaciones extracutáneas (sistema nervioso, esqueleto, dientes, ojos, oídos).
La cartografía de pedigrí es fundamental para identificar patrones de herencia (autosómico dominante, recesivo, ligado al X), evaluar riesgo de recurrencia y guiar pruebas y asesoramiento genéticos.
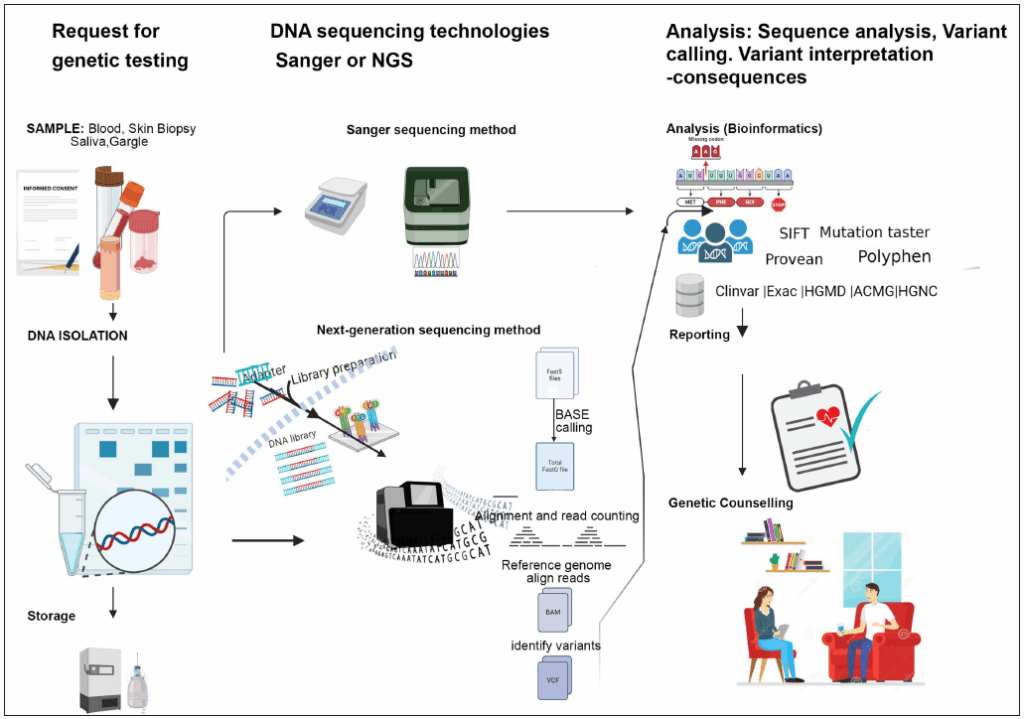
Representación pictórica del flujo de trabajo de un caso sospechoso de genodermatosis.
Existen dos enfoques en la evaluación:
- Fenotipo primero: se realiza un examen clínico completo y análisis de historia familiar antes de ordenar pruebas genéticas; permite definir diagnósticos diferenciales, seleccionar pruebas adecuadas e iniciar terapias.
- Genotipo primero: se ordena la prueba genética antes de fenotipar; puede ser menos eficaz (rendimiento ~50% para exoma completo), generar variantes de significado incierto y no reemplaza la evaluación clínica.
El diagnóstico óptimo combina fenotipado detallado y pruebas genéticas, lo que permite asesoramiento genético y terapias de precisión. La ausencia de antecedentes familiares no excluye un trastorno genético, ya que factores como portadoras asintomáticas, muerte temprana, historia incompleta o paternidad falsa pueden complicar la interpretación. Los patrones de herencia no mendeliana también agregan complejidad.
Secuenciación genética
La secuenciación determina el orden de los nucleótidos en el ADN y se utiliza para identificar variantes genéticas en genodermatosis. Existen dos tipos principales:
- Secuenciación de Sanger (SS, primera generación): a) método tradicional, de bajo rendimiento, secuencia un solo gen a la vez; b) preciso, con longitudes de lectura largas (800–1000 pb) y baja tasa de error; c) se usa para confirmar variantes detectadas por NGS, pruebas prenatales y detección de portadores.
- Secuenciación de próxima generación (NGS, segunda generación): a) alta velocidad y rendimiento, permite secuenciar cientos de genes simultáneamente; b) más rápida, rentable y de mayor precisión diagnóstica; método de elección para identificar mutaciones patógenas; c) aplicaciones: paneles de genes, secuenciación del exoma clínico (CES), exoma completo (WES), genoma completo (WGS) y secuenciación de ARN (RNA-seq).
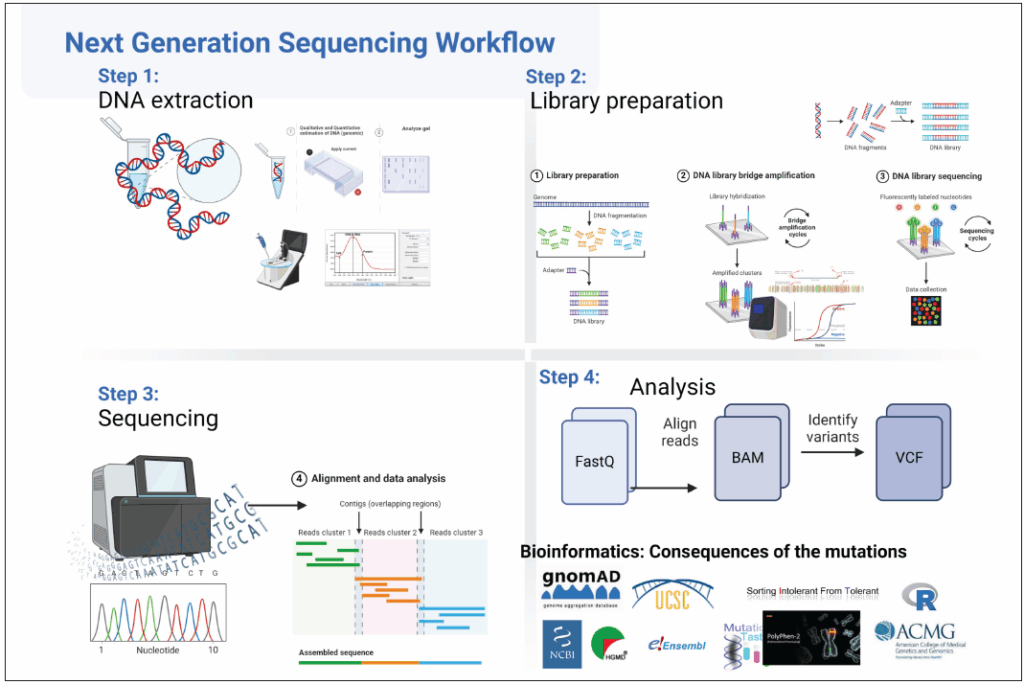
Pasos en la secuenciación de próxima generación
Puntos clave de NGS
- Debe realizarse en laboratorios certificados (CAP, NABL) y los resultados interpretarse por genetistas clínicos.
- Tiempo de respuesta: 4–12 semanas; importante para pruebas prenatales.
- Preferible realizar WES/CES en trío (padres e hijo afectado) para mejorar diagnóstico, especialmente en pediatría.
- Profundidad: número de veces que se lee cada base; cobertura: proporción de regiones objetivo secuenciadas. Alta profundidad y cobertura mejoran la detección de variantes.
- Algunas regiones (genes grandes, pseudogenes, zonas ricas en GC, indels y repeticiones) tienen cobertura limitada, lo que puede causar falsos negativos.
- Validación de NGS mediante Sanger es recomendable.
Desafíos e interpretación
- Solo detecta regiones codificantes; variantes estructurales y no codificantes pueden pasar desapercibidas.
- Variantes de significado incierto (VUS) son comunes; interpretación requiere fenotipado detallado y colaboración clínico-laboratorio.
- Almacenamiento de datos, confidencialidad y accesibilidad son retos importantes.
- La tasa diagnóstica general es ~50%, pero alcanza 95–100% en trastornos monogénicos bien caracterizados (por ejemplo, epidermólisis bullosa).
- RNA-seq puede complementar NGS al detectar transcripciones aberrantes, especialmente en mutaciones de sitios de empalme.
- Reanálisis de exomas con fenotipo completo y seguimiento clínico puede mejorar el rendimiento diagnóstico.
Interpretación de resultados genéticos y variantes
Los resultados de NGS incluyen variantes clasificadas según su efecto clínico: benignas, probablemente benignas, de significado incierto (VUS), probablemente patógenas y patógenas. La interpretación requiere un fenotipado clínico completo, revisión de bases de datos y literatura, así como herramientas bioinformáticas in-silico.
Es común que existan discrepancias entre laboratorios en la interpretación de variantes en alrededor del 10% de los casos, lo que resalta la importancia de la revisión por especialistas. Los resultados negativos o no contributivos pueden deberse a variantes no codificantes o estructurales no detectadas, cobertura insuficiente en ciertas regiones o falta de información clínica adecuada. Por ello, es recomendable conservar las muestras y registrar las características clínicas para permitir análisis futuros y posibles diagnósticos diferidos.
El reanálisis periódico de los exomas, incorporando un fenotipo completo y actualizado, aumenta la probabilidad de identificar variantes relevantes. En la práctica clínica, el enfoque de “fenotipo primero y genotipo después” sigue siendo la estrategia más efectiva para la interpretación, el asesoramiento genético y la planificación de manejo y terapia de precisión.

El enfoque de “fenotipo primero y genotipo después” sigue siendo la estrategia más efectiva para la interpretación, el asesoramiento genético y la terapia de precisión
Cómo leer un informe genético en genodermatosis
| Paso | Qué hacer | Por qué importa | Ejemplos/práctica |
| 1. Contexto clínico | Revisar historia, examen, signos cutáneos y antecedentes familiares | Correlaciona hallazgos genéticos con fenotipo | Eritrodermia al nacer, fotosensibilidad, múltiples tumores |
| 2. Resultados de NGS | Identificar variantes candidatas, revisar gen, exón, posición, cigosidad, herencia, clasificación | Saber qué cambios genéticos podrían explicar el fenotipo | Gen X, exón 5, heterocigoto, autosómico dominante, patógeno |
| 3. Interpretación de variantes | Evaluar evidencia, impacto proteico, conservación, publicaciones previas, relación con la enfermedad | Entender relevancia clínica y decisiones de manejo | Variante conocida como patógena en literatura → confirma diagnóstico |
| 4. VOUS/VUS | Variantes de significado incierto; revisar contexto clínico, pruebas familiares, frecuencia poblacional, estudios funcionales | No guiar tratamiento directo; seguimiento y reevaluación | Variante rara en exoma, padres sanos → VOUS, reevaluar periódicamente |
| 5. Hallazgos incidentales | Identificar variantes con riesgo médico significativo no relacionadas con indicación | Permite intervenciones preventivas, con consentimiento informado | BRCA1/2 → riesgo cáncer mama/ovario |
| 6. Herramientas in-silico | Usar predicciones bioinformáticas (PolyPhen2, SIFT, MutationTaster) | Ayuda a interpretar el posible efecto de la variante | Predicción de daño a la proteína → apoyo en clasificación VOUS |
| 7. Plan de manejo | Integrar resultados con fenotipo, asesoramiento genético y seguimiento | Guiar tratamiento, prevención y estudios familiares | Decidir pruebas adicionales, terapia dirigida, seguimiento longitudinal |
Conclusiones
La evaluación clínica detallada sigue siendo clave en genodermatosis, ya que la historia médica y familiar y el examen físico permiten identificar signos de alerta y patrones de herencia, guiando la selección de pruebas genéticas.
El enfoque “fenotipo primero” sigue siendo preferible, optimizando la interpretación de los resultados y evitando hallazgos inciertos o irrelevantes.
La secuenciación de próxima generación (NGS) ha revolucionado el diagnóstico, siendo más rápida y precisa que la secuenciación de Sanger, aunque esta última sigue siendo útil para confirmaciones puntuales.
La calidad de los datos depende de la profundidad y cobertura de secuenciación, y las limitaciones incluyen regiones difíciles de analizar, errores de interpretación y variantes de significado incierto (VOUS), que requieren revisión continua y correlación con el fenotipo y la historia familiar.
Un enfoque interdisciplinario entre dermatólogos, genetistas clínicos y expertos de laboratorio es esencial para interpretar correctamente los informes genéticos, incluyendo hallazgos incidentales y la aplicación de herramientas in-silico. La combinación de fenotipificación clínica sólida, pruebas genéticas bien seleccionadas y análisis colaborativo permite un diagnóstico más preciso, manejo individualizado y asesoramiento genético adecuado para pacientes y familias.

Un enfoque interdisciplinario entre dermatólogos, genetistas clínicos y expertos de laboratorio es esencial para interpretar correctamente los informes genéticos
Acceda a la parte 1: Genética en dermatología
Dermatología y genética
Fuente
Gupta D, Jose TG, Vishwanathan GB. Genetics for dermatologists. Part 2: Clinical evaluation, sequencing technologies and interpretation. Indian J Dermatol Venereol Leprol 2025.