El ensayo PETITE-T1D demostró que el teplizumab fue seguro y bien tolerado en niños menores de 8 años con diabetes tipo 1 estadio 2, y que la mayoría no progresó a diabetes clínica durante el seguimiento intermedio
Lugones Editorial©
Teplizumab está aprobado en EE. UU. y en otros siete países para retrasar la aparición de la diabetes tipo 1 (DM1) en estadio 3 en niños mayores de 8 años con DM1 en estadio 2. El ensayo multicéntrico PETITE-T1D evaluó la seguridad, tolerabilidad y farmacocinética del teplizumab en niños menores de 8 años con DM1 en estadio 2.
Además, se investigaron la inmunogenicidad, farmacodinámica y el tiempo transcurrido hasta la progresión a la DM1 en estadio 3.
Los autores concluyeron que el teplizumab fue seguro y bien tolerado en niños menores de 8 años con DM1 estadio 2, con eventos adversos esperables y sin riesgos nuevos identificados. Además, la mayoría de los participantes no progresó a diabetes clínica durante el seguimiento intermedio.

El objetivo del estudio PETITE T1D fue investigar la seguridad y tolerabilidad de teplizumab en niños menores de 8 años con diabetes tipo 1 en estadio 2
Teplizumab
La DM1 es una de las enfermedades más comunes en la infancia y su incidencia está aumentando en los niños. El manejo de la enfermedad en niños pequeños es un desafío y representa una alta carga para los cuidadores.
En 2022, la FDA aprobó teplizumab, un anticuerpo humanizado IgG1 que se une a la cadena CD3ε del receptor de linfocitos T, para retrasar la aparición de la DM1 en estadio 3 en individuos de ≥8 años con DM1 en estadio 2.
El curso aprobado de 14 días de infusión intravenosa induce un agotamiento parcial de las células T y reduce la expansión de células T CD8+ autorreactivas.
Los datos demostraron que el tratamiento con teplizumab en individuos ≥8 años con DM1 en estadio 2 preserva la función de las células beta y retrasa la progresión al estadio 3 en 2 a 3 años, aunque no todos los individuos tratados responden. Un hallazgo consistente, relacionado con el mecanismo de acción de teplizumab, es la disminución transitoria en el recuento de linfocitos con el tratamiento.
A pesar de la dificultad de manejar la DM1 en estadio 3 en niños pequeños, teplizumab no se ha investigado previamente en menores de 8 años y actualmente no está aprobado para esta población. Los análisis de subgrupos sugieren que su eficacia es similar en niños ≥8 años y adultos, lo que respalda la investigación de teplizumab en niños más pequeños.
Métodos
- PETITE-T1D (ClinicalTrials.gov NCT05757713) es un estudio multicéntrico, abierto, de un solo brazo y 2 años de duración, diseñado para evaluar la seguridad y farmacocinética de teplizumab en niños menores de 8 años con DM1 en estadio 2.
- Teplizumab se administró por infusión intravenosa diaria durante 14 días mediante catéter periférico, midline o PICC, usando la dosis aprobada para niños ≥8 años ajustada por superficie corporal.
- Los puntos finales primarios incluyeron eventos adversos emergentes del tratamiento (treatment-emergent adverse events, TEAEs), eventos adversos de interés especial (adverse events of special interest, AESIs), TEAEs que condujeron a la retirada, eventos adversos graves, parámetros de laboratorio y signos vitales.
- Los puntos finales secundarios evaluaron concentraciones séricas de teplizumab, anticuerpos anti-fármaco y neutralizantes, y ocupación del receptor CD3.
- Los exploratorios incluyeron tiempo hasta la progresión a DM1 en estadio 3 y niveles de HbA1c.

Los perfiles farmacocinético y farmacodinámico fueron consistentes con estudios previos en niños mayores
Resultados
Se evaluaron 32 niños para inclusión, de los cuales 23 cumplieron los criterios y fueron inscritos. La edad media de los participantes fue 4,8 años (rango 1,7–6,8), el 52,2% eran mujeres y el 95,7% eran de raza blanca. La HbA1c media al inicio fue 37 mmol/mol (5,5 %).
Todos los participantes recibieron teplizumab; 20 completaron el curso completo de 14 días. Tres interrumpieron antes del día 14 según criterios del protocolo (dos recibieron 1 día y uno 12 días de infusión). Un participante completó los 14 días, pero con retraso de un día de infusión por un evento adverso (disminución de hemoglobina). Siete participantes (30,4 %) tuvieron desviaciones importantes del protocolo, sin que ninguna causara retiro del estudio.

El teplizumab fue seguro y tolerable en niños menores de 8 años con diabetes tipo 1 estadio 2, con eventos adversos esperables y sin riesgos nuevos identificados
Perfil de seguridad de teplizumab
- Todos los participantes (N=23) presentaron al menos un evento adverso relacionado con el tratamiento (TEAE). La mayoría fue leve o moderado (95,7% y 73,9%, respectivamente); el 26,1% presentó TEAEs de grado 3. No se registraron TEAEs de grado 4 o 5. Un participante presentó síndrome de liberación de citocinas (CRS) grado 1, sin suspender el tratamiento.
- Los TEAEs más frecuentes incluyeron trastornos gastrointestinales (78,3%), infecciones (78,3%) y trastornos de piel/tejido subcutáneo (73,9%). Durante la dosificación y hasta 28 días después, los más comunes fueron vómitos (52,2%), erupción cutánea (43,5%), diarrea (30,4%), disminución de linfocitos (30,4%), disminución de leucocitos (26,1%) y rash maculopapular (26,1%).
- Tres participantes (13,0%) interrumpieron el tratamiento por TEAEs relacionados con teplizumab (anemia, elevación de enzimas hepáticas y rash maculopapular).
- Dos participantes (8,7 %) tuvieron TEAEs graves. Uno presentó rash maculopapular y trombosis venosa profunda en el sitio del PICC; el otro fue diagnosticado con un tumor glioneuronal de bajo grado aproximadamente 12 meses después de la primera dosis, considerado no relacionado por un experto externo.

Los datos de farmacocinética, farmacodinámica e inmunogenicidad coinciden con lo esperado, mostrando que el fármaco actúa según el mecanismo conocido
Farmacocinética y farmacodinámica
Las concentraciones séricas medias de teplizumab aumentaron hasta un pico al día 14 tras la infusión y disminuyeron a valores cercanos al límite de cuantificación para el día 28. El porcentaje medio de ocupación del receptor CD3 fue 78,4% al día 9 posinfusión, y el porcentaje de linfocitos T circulantes que expresaban CD3 disminuyó de 92,58% al inicio a 85,50 % al día 9.
El recuento de linfocitos disminuyó transitoriamente, alcanzando el nadir alrededor del día 5 y regresando a valores basales al día 28, consistente con el mecanismo de acción de teplizumab.
Inmunogenicidad
Al inicio, todos los participantes con datos disponibles (N=21) fueron negativos para anticuerpos antifármaco. A la semana 2, 18 participantes (90 %) fueron positivos; los títulos aumentaron hasta la semana 12 y luego disminuyeron. Ninguno presentó anticuerpos neutralizantes (NAbs) detectables a la semana 2, pero más de la mitad fueron positivos para NAbs en semanas 4, 12 y 26.
A la semana 52, ningún participante presentó NAbs. La presencia de anticuerpos anti-fármaco no afectó la farmacocinética de teplizumab, aunque los participantes positivos para NAbs tuvieron concentraciones séricas más bajas al día 28.

La mayoría de los niños no progresó a diabetes tipo 1 estadio 3 durante el seguimiento interino
Progresión a diabetes tipo 1 en estadio 3 y HbA1c
Dos participantes progresaron a estadio 3 durante el seguimiento interino (mediana 51,9 semanas). Uno fue diagnosticado a las 12,4 semanas y el otro a las 26,4 semanas tras el inicio del tratamiento. La probabilidad estimada de permanecer libre de progresión fue 89,6 % (IC 95 % 64,3–97,3 %).
Los niveles de HbA1c se mantuvieron estables durante el estudio hasta la semana 52, sin cambios clínicamente significativos y sin diferencias entre cuartiles de títulos de anticuerpos o entre participantes positivos y negativos para NAbs.
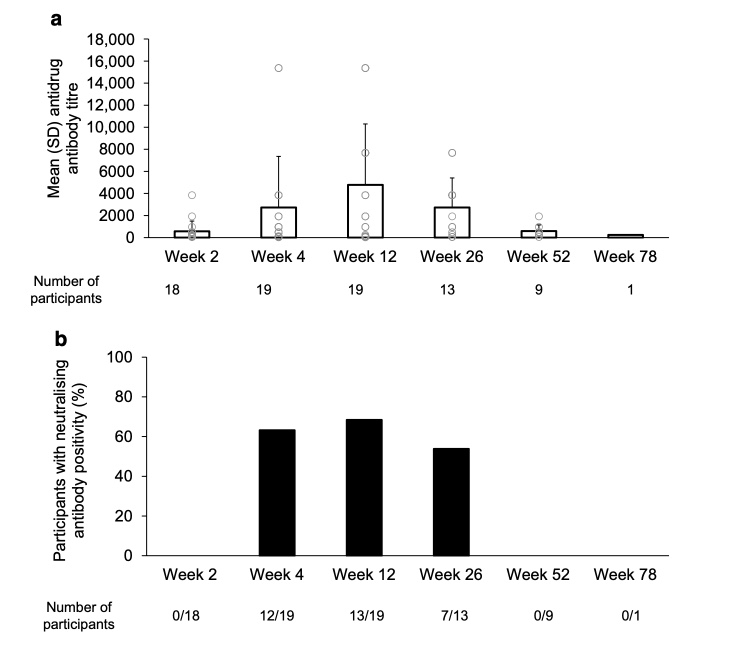
Títulos de anticuerpos anti-fármaco (a) y porcentaje de participantes con anticuerpos neutralizantes (NAbs) (b) (población de inmunogenicidad) después de la línea base
Discusión
El análisis interino de PETITE-T1D proporciona la primera evaluación de seguridad y tolerabilidad de teplizumab en niños menores de 8 años con DM1 en estadio 2, incluyendo datos sobre inmunogenicidad, farmacocinética, farmacodinámica y progresión a estadio 3.
Los TEAEs más frecuentes relacionados con teplizumab fueron vómitos, erupción cutánea, disminución de linfocitos, leucopenia y diarrea. La mayoría fueron leves o moderados. El síndrome de liberación de citocinas (CRS) fue leve y poco frecuente (4,3 %), similar a lo observado en ensayos previos en niños ≥8 años, y no se identificaron nuevos riesgos.
Respecto del participante con tumor glioneuronal de bajo grado, un experto externo consideró que el evento probablemente no estaba relacionado con teplizumab, dado el crecimiento lento y la rareza de este tumor.

La probabilidad estimada de permanecer libre de progresión fue similar a la observada en ensayos previos en ≥8 años
Como en estudios previos, se observó inmunogenicidad: los títulos de anticuerpos anti-fármaco alcanzaron un máximo a la semana 12 y luego descendieron, y los anticuerpos neutralizantes fueron transitorios. La ocupación del receptor CD3 y la disminución transitoria de linfocitos circulantes fueron consistentes con el mecanismo de acción conocido de teplizumab y con datos de ensayos en niños mayores.
Dos participantes progresaron a DM1 estadio 3 durante el seguimiento interino. La probabilidad estimada de permanecer libre de progresión fue similar a la observada en ensayos previos en ≥8 años y mayor que la reportada en estudios observacionales de niños <11 años, aunque no pueden realizarse comparaciones directas por diferencias basales y metodológicas.
Conclusiones
En conclusión, teplizumab fue bien tolerado en niños menores de 8 años con diabetes tipo 1 en estadio 2, mostrando un perfil de seguridad consistente con lo observado en niños mayores y en la experiencia post-comercialización. Los resultados corresponden a un análisis interino; los datos completos se analizarán al finalizar el estudio de 104 semanas.

Teplizumab abre la posibilidad de tratar a niños más pequeños, lo cual representa un avance en la prevención temprana de la diabetes tipo 1
Teplizumab en niños con diabetes tipo 1 en estadio 2
Fuente
Gitelman SE, Simmons K, Sherr JL, et al. Safety and pharmacokinetics of teplizumab in children less than 8 years of age with stage 2 type 1 diabetes. Diabetologia 2025.