Estudio longitudinal de los diferentes patrones de progresión en el carcinoma cutáneo de células escamosas de alto riesgo
Sello Editorial Lugones©
El carcinoma cutáneo de células escamosas (CEC) es la segunda causa de muertes por cáncer de piel en Europa. Existen pocos estudios que hayan analizado las distintas vías de progresión de este tumor en su historia natural.
Introducción
El carcinoma epidermoide cutáneo (CEC) es la segunda neoplasia cutánea maligna en frecuencia luego del carcinoma basocelular en España. También es la segunda causa de mortalidad por cáncer de piel tras el melanoma. Es un tumor con un bajo potencial metastásico.
El CEC metastatiza preferentemente por vía linfática en el 3-5% de los casos, dependiendo de la localización, del tamaño, de la invasión en profundidad, de la invasión perineural o de la afectación ósea.
Por otro lado, la biopsia selectiva del ganglio centinela (BSGC) es una técnica quirúrgica que se desarrolló ampliamente en otros tumores, como el melanoma, en base a su propensión a las metástasis regionales linfáticas, sin que tuviera un impacto en la supervivencia de estos pacientes. En el caso del CEC, la utilidad de la BSGC es aún desconocida, siendo su porcentaje de positividad del 8-10%.
Existen pocos estudios publicados sobre la historia natural en términos de progresión del CEC, o bien que se hayan focalizado en el tiempo de evolución de las distintas formas de recidiva en la progresión de este tumor.
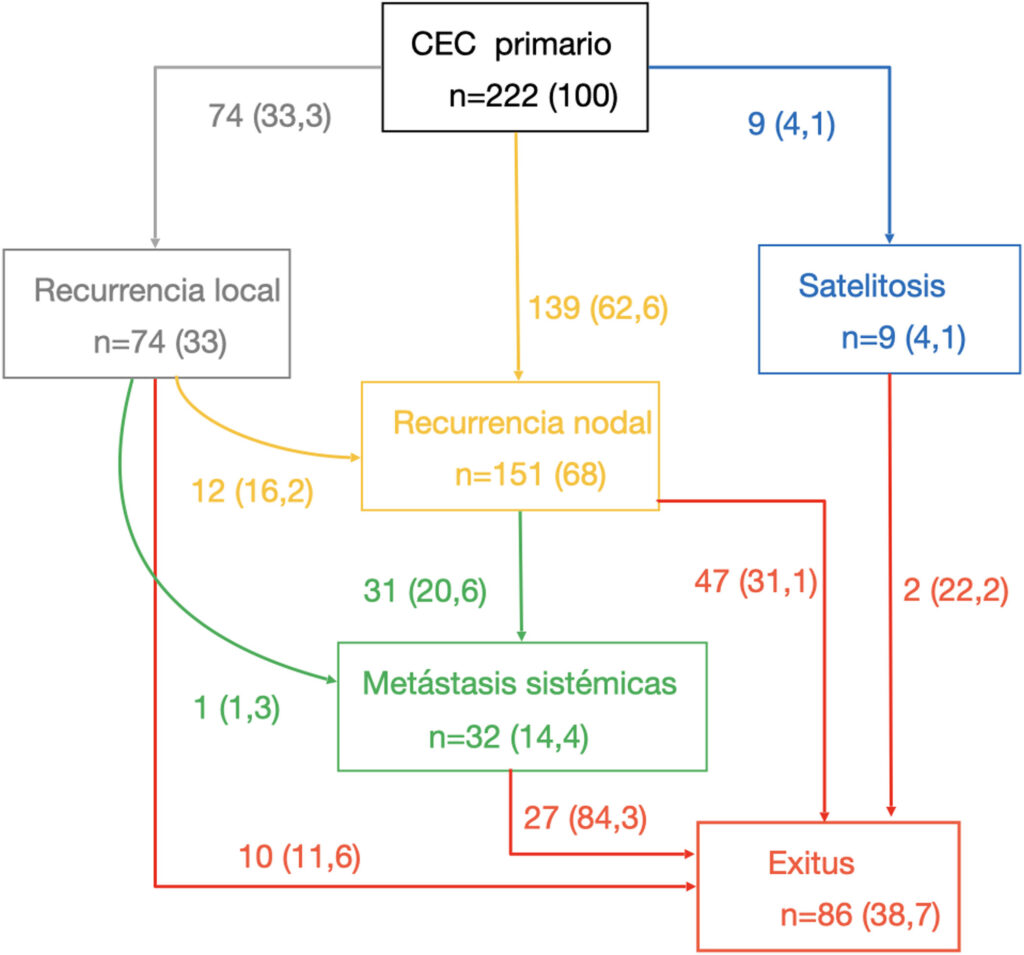
Figura: Tipo de recidiva y diferentes vías metastásicas de los 222 pacientes con carcinoma cutáneo de células escamosas de alto riesgo que tuvieron recaídas durante su seguimiento
Objetivos
El objetivo primario de este estudio es analizar las diferentes vías de progresión del CEC (recurrencia local, satelitosis, recurrencia linfática regional o metástasis a distancia) junto con el tiempo de evolución de estas. Como objetivos secundarios se analiza la relación de las distintas variables clínicas y patológicas con las diferentes formas de progresión.
Materiales y métodos
Estudio observacional retrospectivo multicéntrico de los CEC consecutivos de alto riesgo englobados en el proyecto SQUAMATA.
Resultados
De los 1.346 pacientes incluidos, tuvieron recaída 222 pacientes. La vía de progresión más frecuente fue la vía linfática (62,6%). El 20,2% de los casos con progresión linfática desarrolló metástasis a distancia. Un solo caso (3,1%) de metástasis a distancia fue luego de la recidiva local sin metástasis linfáticas previas. La mediana del tiempo hasta el exitus por la enfermedad fue mayor en los pacientes que desarrollaron metástasis sistémicas que en aquellos fallecidos por progresión locorregional.
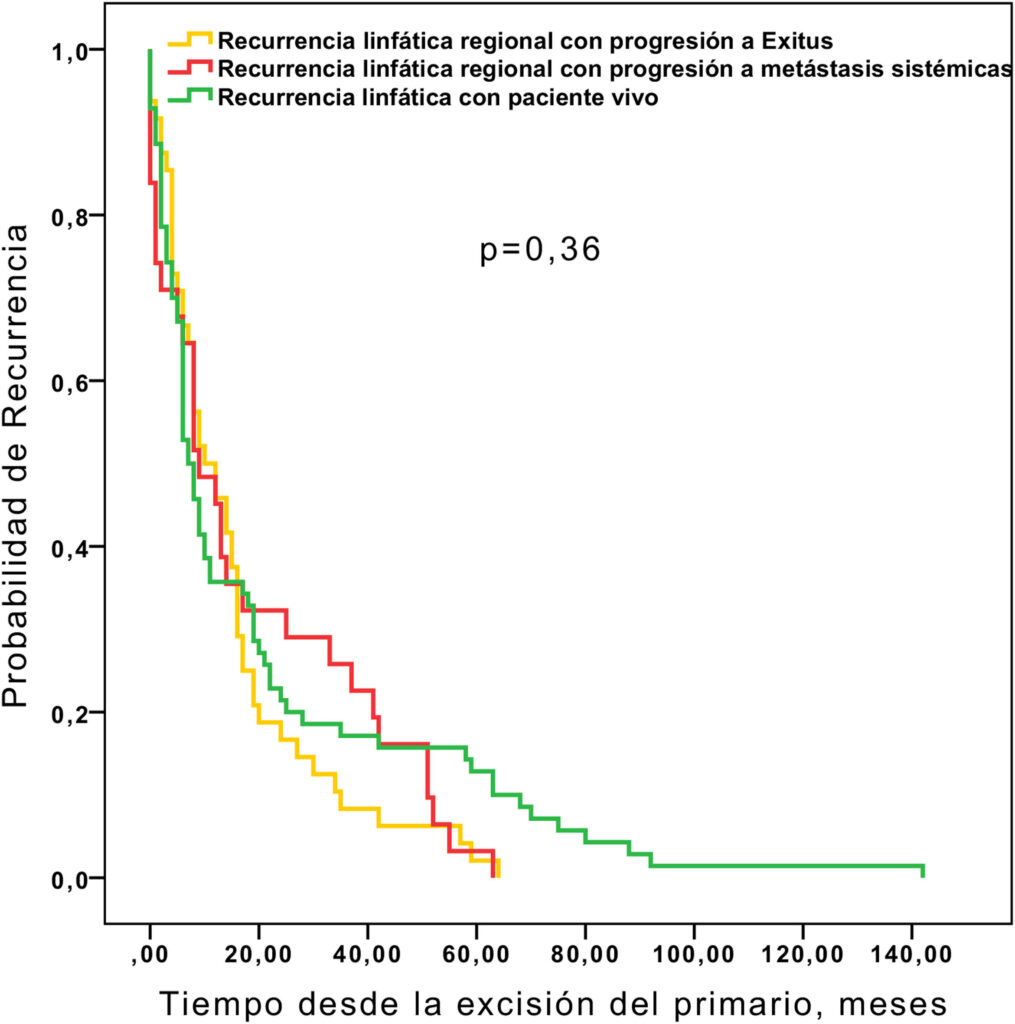
Figura: Supervivencia hasta la recurrencia linfática en función de si los pacientes permanecían libres de enfermedad, fallecían por progresión regional de su enfermedad, o bien progresaban a metástasis sistémicas (n=152).
Conclusiones
El presente estudio muestra que la progresión más frecuente para los CEC de alto riesgo es la vía linfática, y que esta vía es prácticamente obligatoria antes del desarrollo de metástasis sistémicas.
El proceso metastásico es un complejo proceso en el que unas células genéticamente inestables se adaptan a un microambiente tisular diferente a su tejido de origen. Este proceso no es aleatorio, sino que las células tumorales generalmente tienen cierta apetencia por tejidos determinados en función de la estirpe tumoral en un modelo de diseminación denominado originalmente «semilla y terreno» por Paget en el siglo XIX.
Este modelo explica por qué ciertos tumores como el cáncer de mama frecuentemente metastatizan en pulmón, hueso, hígado o cerebro, mientras que otros, como el cáncer de próstata, lo hace más en hueso. O bien que el melanoma uveal característicamente metastatice más a hígado, o bien los sarcomas a pulmón.
En el caso de los CEC, la implicación más importante de estos hallazgos sería el manejo locorregional de la enfermedad. Más de la mitad de los pacientes en el estudio fallecen por progresión de las metástasis regionales linfáticas, lo que plantea si una disección linfática electiva podría beneficiar a estos pacientes, como en el caso del carcinoma de células escamosas de la cavidad oral.
Esta progresión ordenada y gradual que muestra el CEC desde el tumor primario al ganglio linfático regional y de aquí a la diseminación metastásica es la base teórica ideal que avala la utilización terapéutica de la biopsia selectiva del ganglio centinela (BSGC).
Es precisamente lo que hace décadas se denominó «hipótesis de la incubadora» por los defensores de la BSGC en el melanoma, en contraposición con la «hipótesis del marcador», que establecía que la presencia de metástasis en los ganglios linfáticos regionales constituye no un paso previo, sino un marcador de que el tumor ya se habría diseminado a otros órganos.
La observación de que el tiempo medio de supervivencia es mayor para las vías metastásicas que implican la aparición de metástasis sistémicas con respecto a las mismas vías, pero sin la diseminación sistémica apoya en cierta medida esta «hipótesis de la incubadora», hecho que no se observa en estudios similares para el melanoma.
En nuestra serie, el 11,6% de las muertes específicas fueron por progresión local. Estos datos muestran la importancia del control local de CEC.
Como conclusión, la vía metastásica más frecuente de diseminación para el CEC es la vía linfática. Esta vía es prácticamente necesaria para la diseminación sistémica. La progresión regional de las metástasis linfáticas es también la causa principal de fallecimiento. Las medidas enfocadas al control regional de este tumor, como la BSGC, la disección ganglionar electiva o la radioterapia adyuvante, podrían tener un papel en la mejora de la supervivencia en esta enfermedad.
Fuente
Tejera-Vaquerizo A, Cañuetoc J, Gómez-Tomás A, et al. Longitudinal study of different progression patterns in high-risk cutaneous squamous cell carcinoma. Actas Dermosiliograf 2024; doi: 10.1016/j.ad.2024.03.018.