Uno de los efectos funcionales más estudiados de la señalización de la insulina en el músculo esquelético es el aumento en el transporte de glucosa
Sello Editorial Lugones©
Revista de la Sociedad Argentina de Diabetes
- Martín Alejandro Pavarotti, Universidad Nacional de Cuyo, Mendoza, Argentina
- Martín Rodríguez, Instituto de Clínica Médica y Diabetes, Mendoza, Argentina
El músculo esquelético (ME), debido a su significativo tamaño y función, representa el tejido que más energía demanda durante la actividad física. En respuesta a esta demanda, ha desarrollado un sistema altamente especializado para almacenar energía y satisfacer sus necesidades metabólicas. Para alcanzar esta eficacia en el almacenamiento y abastecimiento de nutrientes, en particular de glucosa, el ME depende de una incorporación nutricional eficaz. La relación entre la insulina y el ejercicio ilustra un ejemplo de equilibrio complejo y de adaptación, en el que dos fuerzas reguladoras metabólicas se contraponen en contextos cambiantes.
El aumento de la insulina en la sangre comunica al ME la presencia de niveles elevados de glucosa plasmática. Aunque la insulina se secreta tras la ingesta y es la principal hormona que aumenta el almacenamiento de glucosa y ácidos grasos en forma de glucógeno y triglicéridos, respectivamente, el ejercicio es una situación fisiológica que exige la movilización y oxidación de las reservas energéticas. Por lo tanto, durante la actividad física, los efectos del almacenamiento inducidos por la insulina deben mitigarse mediante la inhibición de la liberación de insulina durante el ejercicio, y la activación de los mecanismos sistémicos y locales de movilización de energía.
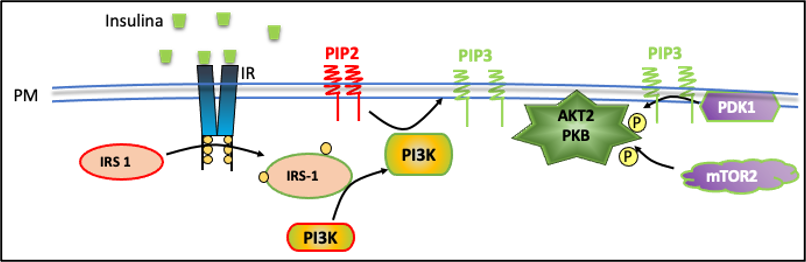
Figura: Primeros eventos de señalización activados por la insulina
La interacción de la insulina con su receptor da lugar a una compleja cascada de señales que promueve la captación de glucosa y la síntesis de glucógeno. Uno de los efectos más estudiados de la señalización insulínica en el ME es el incremento en la captación de la glucosa muscular. Tanto la insulina como la actividad contráctil aumentan la entrada de glucosa en el ME, proceso que involucra la translocación y fusión de vesículas que contienen el transportador de glucosa GLUT-4 en la membrana (GSV: vesículas de almacenamiento de GLUT-4).
Así, los estímulos mencionados provocan el traslado de las GSV hacia la superficie celular, donde se fusionan, lo que aumenta la presencia de GLUT-4 y favorece la captación de glucosa del entorno intersticial. Este proceso de fusión se conoce como “exocitosis de GLUT-4”.
Tras la actividad física, es necesario reponer las reservas de energía consumidas, en especial, el glucógeno en el músculo. El proceso se ve favorecido por un aumento de la sensibilidad a la insulina en los músculos previamente ejercitados, lo que facilita la utilización de la glucosa en la resíntesis del glucógeno. Este trabajo de revisión abarca los nuevos actores de la cascada de señalización de la insulina, el transporte de GLUT-4 y las interacciones insulina-ejercicio durante y después de la actividad física. Además, explora los efectos del entrenamiento físico regular sobre la acción de la insulina.
Referencias
I. Sylow L, Tokarz VL, Richter EA, Klip A. The many actions of insulin in skeletal muscle, the paramount tissue determining glycemia. Cell Metab 2021;33(4):758-780.
II. Jaldin-Fincati JR, Pavarotti M, Frendo-Cumbo S, Bilan PJ, Klip A. Update on GLUT-4 vesicle traffic. A cornerstone of insulin action. Trends Endocrinol Metab 2017;28(8):597-611.
III. Richter EA, Sylow L, Hargreaves M. Interactions between insulin and exercise. Biochem J 2021;478(21):3827-3846.
IV. Lawrence MC. Understanding insulin and its receptor from their three-dimensional structures. Mol Metab 2021;52:101255.
V. De Meyts P, Whittaker J. Structural biology of insulin and IGF1 receptors: implications for drug design. Nat Rev Drug Discov 2002;1(10):769-783.
VI. De Meyts P. The insulin receptor and its signal transduction network. En: Feingold KR, Anawalt B, Blackman MR, et al., editors. Endotext. South Dartmouth (MA): MDText.com, Inc.; 2000 Disponible en: http://www.ncbi.nlm.nih.gov/books/NBK378978/ [Consultado febrero 2023].
VII. Boucher J, Kleinridders A, Kahn CR. Insulin receptor signaling in normal and insulin-resistant states. Cold Spring Harb Perspect Biol 2014;6(1):a009191.
VIII. Kaburagi Y, Yamauchi T, Yamamoto-Honda R, et al. The mechanism of insulin-induced signal transduction is mediated by the insulin receptor substrate family. Endocr J 1999;46(Suppl):S25-34.
IX. Shaw LM. The insulin receptor substrate (IRS) proteins. Cell Cycle 2011;10(11):1750-1756.
X. Chang L, Chiang S-H, Saltiel AR. Insulin signaling and the regulation of glucose transport. Mol Med 2004;10(7-12):65-71.
XI. Świderska E, Strycharz J, Wróblewski A, et al. Role of PI3K/Akt pathway in insulin-mediated glucose uptake. Intech Open; 2018.
XII. Shepherd PR. Mechanisms regulating phosphoinositide 3-kinase signaling in insulin-sensitive tissues. Acta Physiol Scand 2005;183(1):3-12.
XIII. Farese RV. Function and dysfunction of aPKC isoforms for glucose transport in insulin-sensitive and insulin-resistant states. Am J Physiol Endocrinol Metab 2002;283(1):E1-11.
XIV. Osorio-Fuentealba C, Klip A. Dissecting signaling by individual Akt/PKB isoforms, three steps at once. Biochem J 2015;470(2):e13-16.
XV. Manning BD, Toker A. Akt/PKB signaling: navigating the Network. Cell 2017;169(3):381-405.
XVI. Nomiyama R, Emoto M, Fukuda N, et al. Protein kinase C iota facilitates insulin-induced glucose transport by phosphorylation of soluble NSF attachment protein receptor regulator (SNARE) double C2 domain protein b. J Diabetes Investig 2019;10(3):591-601.
XVII. Mann G, Riddell MC, Adegoke OAJ. Effects of acute muscle contraction on the key molecules in insulin and akt signaling in skeletal muscle in health and in insulin resistant states. Diabetology 2022;3(3):423-446.
XVIII. Carracedo A, Pandolfi PP. The PTEN-PI3K pathway: of feedbacks and cross-talks. Oncogene 2008;27(41):5527-5541.
XIX. Stenmark H. Rab GTPases as coordinators of vesicle traffic. Nat Rev Mol Cell Biol 2009;10(8):513-525.
XX. Sun Y, Bilan PJ, Liu Z, Klip A. Rab8A and Rab13 are activated by insulin and regulate GLUT-4 translocation in muscle cells. Proc Natl Acad Sci U S A. 2010;107(46):19909-19914.